【FDA483】QC仪器未做PQ,日常验证无方案、报告,未定期计量
2024-01-10 20:54 浏览:28
为帮助制药人更好了解FDA483、警告信,博普智库联合西门君-孙致远老师,每日更新FDA483系列解读内容,同时我们还搭建西门君专属社群,定期组织线上答疑互动、线上培训和线下沙龙活动,敬请关注!(文末可免费领取《西门君 FDA483发现项(2023财年)》实体书)2023.12.05-2023.12.11 FDA对印度Torrent公司进行了审计。今天分享的是发现项2中的AQC仪器未做PQ,日常验证无方案、报告,未定期计量
The responsibilities and procedures applicable to the quality unit are not in writing and fully followed for your formulation manufacturing operations.
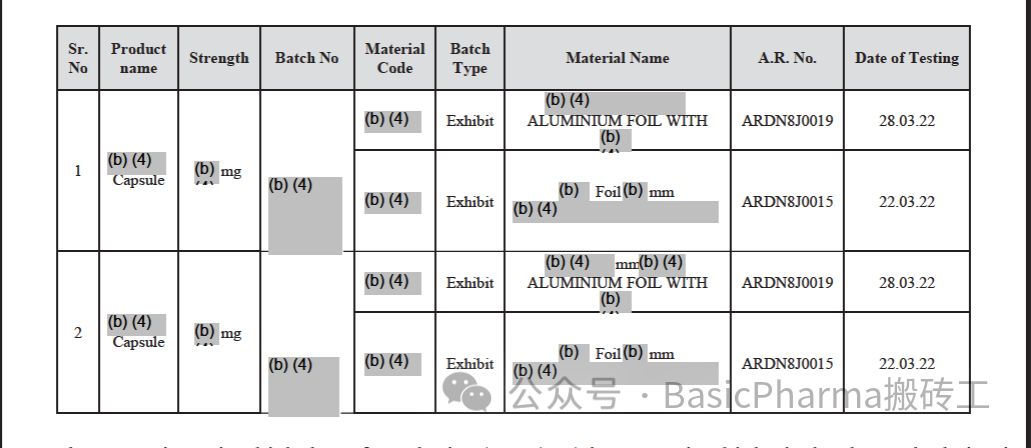
适用于质量部门的职责和程序不是书面的,并且在你的制剂生产操作中没有完全遵循。You failed to perform a performance qualification (PQ) for the xxx tester (ID #TPL-OC-149) located in the Packing Material Test (Room # xxx) and released the equipment for use on February 04.2020.
您未能对位于包装物料测试室(xxx室)的xxx测试仪(ID #TPL-OC-149)进行性能确认(PQ), 该设备于2020年02月4日放行供使用。In addition, you failed to prepare a qualification protocol and report for the qualification of the equipment as required per your Validation Master Plan (VMP/BI/ONC/01) and you failed to include the equipment in a calibration program as required by SOP#BIOC-088-01 (Operation and Cleaning of xxx Tester. February 20. 2020 effective date). The equipment was utilized to perform aluminum foil testing utilized in blister packaging for the following xxx Capsules ( xxx # xxx) exhibit batches listed below.
此外,您未能按照您的验证主计划(VMP/BI/ONC/01)的要求准备设备的确认方案和报告,并且您未能按照SOP # BIOC-088-01(XXX测试仪的操作和清洁)的要求将设备包括在校准程序中。20202年02月20日生效日期)。该设备用于对下列xxx胶囊(xxx # xxx)申报批的泡罩包装进行铝箔测试。西门:
通常 1058 C 类,此类仪器通常包括仪器硬件和其控制系统(软件),用户需对仪器的功能 要求、操作参数要求、系统配置要求等详细描述。如高效液相色谱仪、气相色谱仪 等。此类仪器设备需要安装确认、运行确认和专门的性能确认,并制定相关操作、 维护保养、校正和确认的标准操作规程。而参考自2022年两份来自USP官方的Stimuli article启动文章中的引述,其对ABC三类有了更加详细的分类,C类细分为了C1到C3,B1-C1,考虑 PQ, C2以上需要PQ,如下:This SRP (3) proposed splitting the 〈1058〉 B and C categories into two groups segmented according to rmware/software complexity: B1 to B3
该SRP (3)建议将〈1058〉 B类和c类分为两组,根据固件/软件的复杂性进行划分:B1到B3
and C1 to C3. This would have the added advantage of compatibility with the Good Automated Manufacturing Practice (GAMP 5) Forum's GoodPractice Guide (GPG) on Validation of Laboratory Computerized Systems GPG (4). The groups would be segmented as follows:
从C1到C3。这将具有与良好自动化制造规范(GAMP 5)论坛关于实验室计算机化系统验证的良好实践指南(GPG)GPG(4)兼容的额外优势。这些小组将按如下方式划分:
GROUP 2: C1 to C3
1. Analytical systems with commercial noncongurable application software; C1
带有不可配置的市售应用软件的分析系统:C1
2. Analytical systems with commercial congurable application software; C2
带有市售可配置应用软件的分析系统:C2
3. Analytical systems with commercial congurable and customizable application software that enables users to dene custom reports,custom calculations, or macros; C3
具有市售可配置和自开发应用软件的分析系统,使用户能够获得定制报告、定制计算或宏指令;C3
Clearly, the amount of qualication effort needed to demonstrate tness for intended use increases both within groups and between groups.
显然,证明预期用途适用性所需的验证确认工作量有所增加。
以下为第二份Stimuli Article先导文章中对于其不同分类的验证颗粒度的预想如下(stimuli article只是USP的设想,并不是正式要求)2. 目前验证,认可度比较高的是,方案protocol和报告report分离。
3. PQ、变更控制和定期审查的实践: 每个 PQ、维护和校准活动都应形成文件。应建立变更控制,以控制仪器配置的 变更,包括固件和软件。关键仪器应进行定期审查,以确保系统仍在控制之下。审查的典型领域包括确认状态、 用户程序的有效性、变更控制记录、系统产生的记录的正确性和完整性、电子记录的备份和恢复,以及测试结果的审核和签字。
这里的设备显然B类以上,没有定期计量,显然认可度不高。*? 本文中观点不代表任何公司和组织,如有觉得有冒犯的地方,请于后台联系,我会及时删除。现博普智库联合行业专家西门君-孙致远老师重磅推出《西门君 FDA483发现项(2023财年)》一书,助力制药人深度学习483!
关注我们??,获取更多行业干货、免费资料、免费课程~