
【识别微信二维码,加入我们的微信群!请注明:姓名+研究方向】
玻璃是传统的药用包装材料,其在输液瓶上的应用已有百年的历史。药用玻璃包装容器有可能影响药品质量,选择和使用与药品具有良好相容性的玻璃包装容器,避免因药用包装容器可能导致的安全性风险是研究过程中需要重点关注的方面。近年来,玻璃与注射液的相容性研究逐渐引起了公众的关注,本文对相关的法规进行了提炼以及对文献进行了总结,期望对大家有所帮助。
药用玻璃容器分类
目前用于包装注射液的玻璃按照包装形式分类主要有输液瓶、安瓿、西林瓶、笔式注射器玻璃套筒、卡式瓶等。按照容器的制备工艺分类又可分为管制玻璃容器和模制玻璃容器。管制玻璃容器多适用于包装小容量注射液以及粉末,如安瓿瓶、笔式注射器玻璃套筒和预灌封注射器等;模制玻璃容器多适用于大容量注射剂、小容量注射液和粉末(模制注射剂瓶)的包装,如钠钙玻璃输液瓶、中硼硅玻璃输液瓶等。而按照玻璃材质或者耐水性能进行分类,国内按照表1进行分类;国外按照表2进行分类。
表1 中国国家标准对玻璃的分类情况
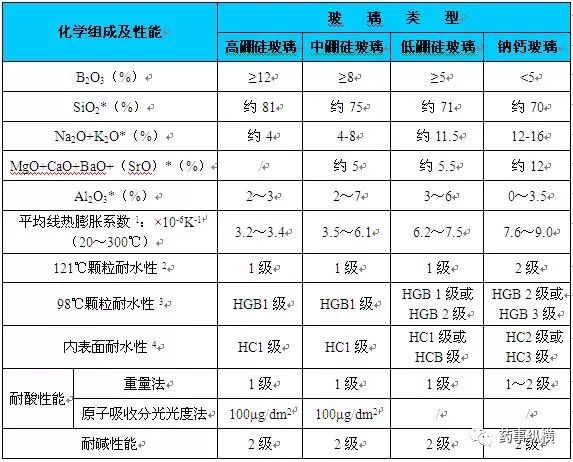
表2 美国、欧洲以及日本对玻璃的分类
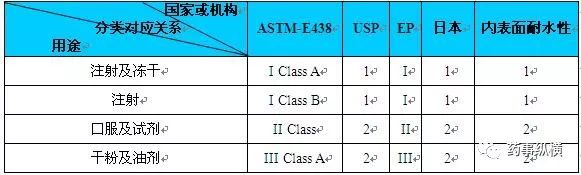
Ⅰ型玻璃:也称中性玻璃,因其本身的化学稳定性而具有较高的耐水性。Ⅱ型玻璃:通常指经过适当的表面处理而得到的较高耐水性的钠钙玻璃。Ⅲ型玻璃:通常指具有中等耐水性的钠钙玻璃。
影响玻璃质量的因素
玻璃内表面受到各种因素的影响而产生质量问题,可能涉及到的影响因素如表3。
表3 影响玻璃内表面耐受性的因素

玻璃包装容器可能出现的问题
溶液澄清度与颜色、可见异物、不溶性微粒
包装容器由于清洗和高温灭菌等工艺,或者药液和处方等因素对玻璃材质造成侵蚀导致溶液澄清度与颜色、可见异物、不溶性微粒等问题。澄明度指的是液体的清澈程度,检查的是可见异物和可见浑浊物。而可见异物和不溶性微粒有区别,可见异物和微粒均为存在于注射液中的非有效的不溶性物质。主要有以下区别①可见异物为肉眼可见,微粒还包括肉眼不可见的细小微粒;②检查方法不同:可见异物可以通过肉眼或设备检查,但微粒只能借助仪器进行检查;③检查对象不同:可见异物是所有注射剂都必须进行检查,微粒主要是针对静脉用注射剂;④前提条件:微粒检查对象首先必须是可见异物检查合格的产品;⑤粒径不同:可见异物是>50 μm的颗粒,微粒是>10 μm 的颗粒。可见异物采用通常采用灯检法检查。而在进行不溶性微粒考察时,可参考中国药典附录IXC进行检查。因玻璃微粒比溶剂重,微粒易积聚在容器底部,为了得到准确数据,应对溶液进行充分振摇后进行测定。
脱片
玻璃的脱片,就是通常说的悬浮在药液中的闪光薄片,其原因是玻璃受到了侵蚀作用,药物与玻璃接触,在两者界面发生了一定的反应,形成了难溶性的硅酸盐类物质,最后在内部应力或热膨胀的作用下,从玻璃表面剥离下来,形成所谓的脱片。酸性、碱性、中性、盐等介质都可能对玻璃发生侵蚀作用。一般认为,在酸性及中性介质中,侵蚀是以介质与玻璃之间的离子交换为代表性的反应;而另一形式的侵蚀反应(主要发生在碱性溶液中)的特点是玻璃网络结构的解聚。玻璃的脱片对注射液质量的影响是显而易见的,它会影响药液的澄明度、可见异物等相关性能。例如。碳酸氢钠注射液、氨茶碱注射液等pH值较高的药品在采用低硼硅玻璃安瓿包装进行相容性研究时会出现脱片。
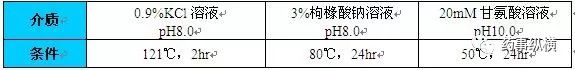
表4加速脱片的介质和条件
(USP<1660>玻璃内表面耐受性评估指南)
吸附
此外,某些药物在玻璃输液瓶中会发生吸附现象,特别是对于生物制剂,该问题可能更为严重。吸附会影响药物的含量,降低药品的药效。例如一些研究表明玻璃输液瓶可对胰岛素产生一定的吸附作用,试验结果表明当胰岛素溶液pH为5时,吸附作用最大,吸附率约为30%;并发现随着pH值增大(pH>5),对胰岛素的吸附逐渐减小。
pH值改变
药品包装材料可能影响药液的pH,在制备过程或者储存过程中导致药品pH的改变。在具体案例分析时,首先应该确定是否由于玻璃材料引起,因为各种工艺步骤或者橡胶塞等都有可能影响药液的pH,其次应该查找影响pH变化的原因,进而针对性的更换包材种类或者厂家。例如,部分研究人员发现对于某些厂家生产的玻璃输液瓶灌装氯化钠注射液后经过灭菌周期,氯化钠注射液的pH值由5.5上升到7.8,但对于其他厂家生产的玻璃瓶却没有出现pH值明显升高的情况。
重金属离子溶出
玻璃包装容器中组分多为无机盐。迁移入注射剂药液的常见元素包括Si、Na、K、Li、Al、Ba、Ca、Mg、B、Fe、Zn、Mn、Cd、Ti、Co、Cr、Pb、As、Sb等。应结合特定玻璃容器的组分以及添加物质的信息,对所含有的离子进行定量检查并进行安全性评估,主要参考ICH3Q的元素杂质的相关规定,如表5。
表5 玻璃容器中
常用金属元素的每日允许摄入量(注射途径)

玻璃材料相容性步骤
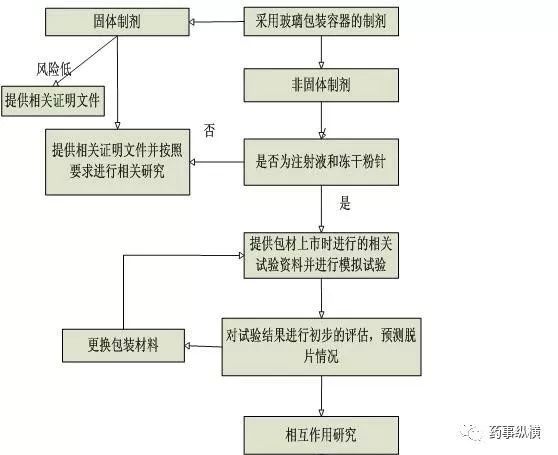
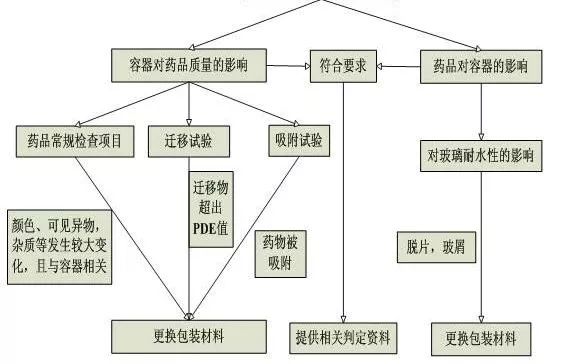
为了确保玻璃包装容器对药物安全性,需要进行药物和包装材料的相容性研究。相容性研究内容应包括包装容器对药品的影响以及药品对包装容器的影响,主要分为如下六个步骤:1)确定直接接触药品的包装组件;2)了解或分析包装组件材料的组成、包装组件与药品的接触方式与接触条件、生产工艺过程,如:玻璃容器的生产工艺(模制或管制)、玻璃类型、玻璃成型后的处理方法等,并根据注射剂的理化性质对拟选择的玻璃容器进行初步评估;3)对玻璃包装进行模拟试验,预测玻璃容器是否会产生脱片以及其他问题;4)进行制剂与包装容器系统的相互作用研究,主要考察玻璃容器对药品的影响以及药品对玻璃容器的影响,应进行药品常规检查项目检查、迁移试验、吸附试验,同时对玻璃内表面的侵蚀性进行考察;5)对试验结果进行分析,安全性评估和/或研究;6)对药品与所用包装材料的相容性进行总结,得出包装系统是否适用于药品的结论。玻璃容器相容性研究决策树见图1。
图1 玻璃容器相容性研究决策树
结语
包装材料对药物的影响受到制剂工作者越来越广泛的关注,也是制剂处方开发过程中需要特别注意的地方。玻璃包装容器对药品质量的影响,可能来自玻璃材质和药品等多个方面,实际工作中遇到的很多问题其实需要跨学科的知识,所以我们除了对法规和药品本身进行研究和理解,同时加深对玻璃材料理化特性的理解,才能在出现问题前有效的规避风险。本文主要对法规的要求和文献进行了提炼和总结,可能有遗漏之处,请大家批评指正。
参考文献
1.化学药品注射剂与药用玻璃包装容器相容性研究技术指导原则(试行)
2.方旻, 曲亚南, 许慧,等. 浅析药用玻璃包装与注射液之间的相容性[J]. 中国医疗器械信息, 2017, 23(9):28-29.
3.王立江, 苏学军, 王文刚,等. 注射液中不溶性微粒国家标准变革和微粒防控技术[J]. 河北医药, 2018(4).
4.朱柳萌.玻璃输液瓶对氯化钠注射液pH值的影响[J].南昌大学学报医学版,1999,39(s1):348.
5.USP
6.EP
7.药典ChP2015
会议培训汇总
| 地点 | 时间 | 会议主题(如需了解详情请点击文字链接查看) |
| 线上 | 3月15-16日 | 【线上】药品研发质量管理体系七大模块从建立到落地实施 |
| 线上 | 3月16-17日 | 【线上】从IND、NDA到商品化生产生命全周期的质量标准与方法验证全解析 |
| 线上 | 3月20-22日 | 【杭州】MAH委托生产合规管理及能力提升实操 |
| 线上 | 3月22-24日 | 【杭州】质量负责人/质量受权人(QP) |
| 线上 | 3月28-29日 | 【线上】临床试验数据管理 |
| 线上 | 3月30-31日 | 【线上】化药工艺开发CQA及CPP评估实操演练 |
报名咨询
更多服务(培训、检测、技术推广)
药驿站公众平台服务窗口:


识别微信二维码,加入我们的微信群!请注明:姓名+研究方向!

版权声明
本公众号所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的媒体或个人可与我们联系(274190388@qq.com),我们将立即进行删除处理。所有文章仅代表作者观点,不代表本站立场。
