
自2020年12月31日英国脱欧过渡期结束后,2021年1月1日起,英国的MHRA注册和UKCA标志正式启用。英国分为大不列颠(简称GB)及北爱尔兰(简称NI)市场,而GB市场包括包括英格兰,苏格兰,威尔士。
进入英国市场的医疗器械,在完成CE、UKCA认证或自我符合性声明后需要在英国医疗器械监管当局Medicines & Healthcare products Regulatory Agency(简称MHRA)的服务系统登记,这个登记过程即MHRA注册。
而英国境外的制造商需要指定一名英国负责人(UK Responsible Person),负责产品在英国的MHRA注册。
这里小编整理了MHRA注册的流程:
1.指定英国负责人(仅针对英国境外制造商)
2.准备登记资料(公司信息及产品资料)
3.系统填写/上传注册信息
4.付款
5.提交注册
6.注册完成,获得凭证
(提交到获得凭证官方周期一般5个工作左右)
另外,特别注意的是,自欧盟2023.03.01颁布MDR过渡期延期法案后,英国监管机构MHRA于2023年7月更新的针对依赖过期或即将到期的CE证书产品的注册指南《Guidance on registration of certain medical devices which are reusable Class I devices, upclassified Class I devices, and/or reliant on expired/expiring CE certificates》,对此前依赖CE证书已进行MHRA注册,和目前用即将到期/已到期的CE证书进行MHRA注册的产品进行指导。同时英国发布了对持CE证书产品在英国的认可时间线(如下):
IVD产品

MD产品
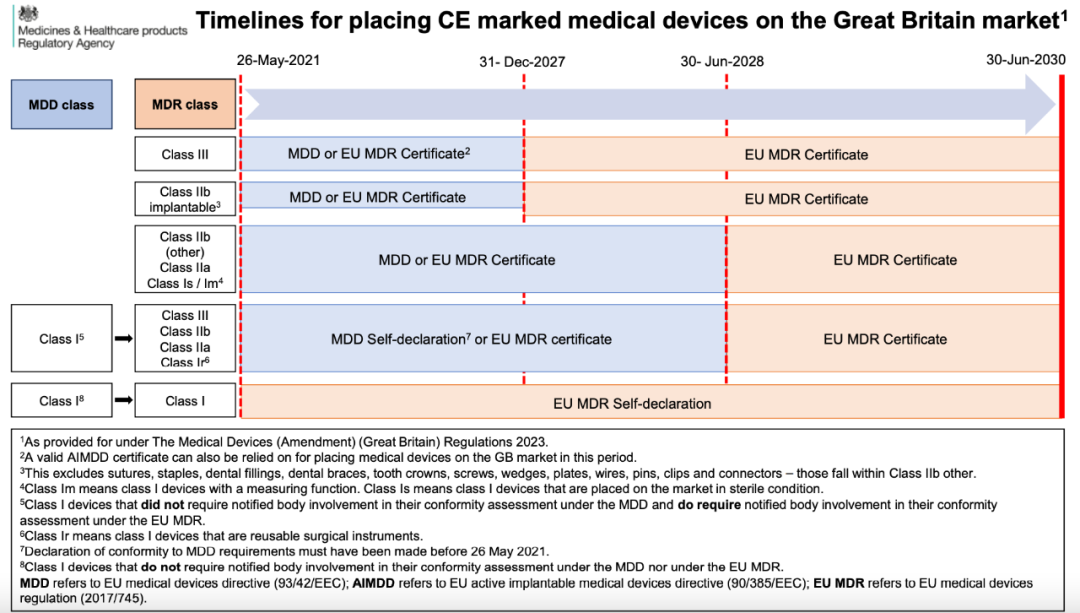
时间线原文链接:
https://assets.publishing.service.gov.uk/government/uploads/system/uploads/attachment_data/file/1166483/Infographic_-_Devices_transition_timeline.pdf
如果有具体产品MHRA注册的问题,请与我们联系。
广东省国瑞中安科技集团有限公司(以下简称“国瑞中安集团”)是一家专注于为医疗器械及体外诊断器械企业提供临床试验研究、全球法规注册和检验检测等综合技术服务的CRO机构。通过多年的发展和积累,我们已经在全球多个重要市场建立了完善的服务网络及专业的本地化团队。

作为一家专业的综合性CRO技术服务商,我们的主要服务项目包括:国内外临床试验研究、法规注册咨询(如中国NMPA、俄罗斯RZN、欧盟CE MDR&IVDR、美国FDA&510K、澳洲TGA、英国MHRA&UKCA、加拿大MDL&MDEL、韩国MFDS、东南亚注册、中亚注册、巴西ANVISA注册等)、产品质量检测、自由销售证书、国内注册检验、体系辅导(MDSAP、ISO13485、QSR820、GMP等)、法规培训、当地授权代表(欧代、美代、东南亚持证人、俄代、巴代、港代)等,为客户提供了一站式的技术解决方案服务。

15816864648