
行业发展
我国医生创造神经免疫病诊断技术并产生全球首个I级方法学推荐证据
近日,北京天坛医院/天津医科大学总医院施福东教授团队基于长期对神经免疫疾病诊治技术的研究积累,自主研发并建立了高质量的神经免疫病实验室诊断技术体系,突破了神经免疫病体液检测诊断技术难题,实现了产品的稳定性,提升了产品的敏感性和特异性。
在此基础上,为响应国家自主科技创新号召和满足京津乃至全国日益增长的临床服务需求,北京天坛医院/天津医科大学总医院共建的京津神经免疫中心孵育出“天津天海新域生物科技有限公司”,致力于实现神经疾病实验室诊断技术和体液标记物的自主创新、标准化和临床应用转化,旨在摆脱国外的技术垄断,解决我国患者转诊时抗体检测结果互认、全球药物临床试验认可的技术需求。(生物谷)
山东省首个规模化的GMP级细胞与基因治疗CDMO平台建成启用
近日,丽山国际细胞医学产业园细胞与基因治疗CDMO平台启用并获得数千万元订单。这是山东省首个规模化的GMP级细胞与基因治疗CDMO平台。
丽山健康集团建成山东省内唯一一家由科技厅认可的免疫细胞与基因治疗CDMO中试基地。该基地高标准建设细胞与基因治疗科研载体,成为推动济南生物医药产业发展的新引擎。基地建有研发中心、检测中心、质粒工艺开发中心、基因载体工艺开发中心、CAR-T细胞工艺开发中心,同时配备空调净化系统、水系统、纯蒸汽系统、二氧化碳及压缩空气等气体系统、仓储系统等公用设施。(济南历下控股集团)
企业动态
星汉德生物全球生产研发中心在新加坡落成启动:首创全封闭自动化细胞治疗生产系统,大幅扩增全球产能并降低成本
近日,星汉德生物(SCG)位于新加坡总部的细胞治疗cGMP生产设施及研发中心正式启用。在新加坡经济发展局的支持下,新设施充分利用并扩展了SCG在先进细胞疗法生产体系和“现货型”多能干细胞(iPSC)技术方面的能力。该设施将为亚太地区、北美和欧洲的合作医院提供细胞治疗产品。
2021年,SCG与Cell Therapy Facility of Singapore Health Sciences Authority(新加坡卫生科学局细胞治疗设施)合作,验证了其专有的封闭式自动化细胞治疗生产系统。该系统已获得新加坡卫生科学管理局(HSA)和美国食品和药物管理局(FDA)的临床试验认证。(医药魔方)
阿斯利康与Quell Therapeutics达成超20亿美元合作,开发多种工程化调节性T细胞(Treg)细胞疗法
近日,阿斯利康宣布与Quell Therapeutics达成协议,以开发多种工程化调节性T细胞(Treg)细胞疗法。Quell将获得阿斯利康8500万美元的预付款,后续有资格进一步获得超过20亿美元的开发和商业化里程款。
协议条款规定将利用Quell专有的Treg细胞工程模块工具箱,开发用于自身免疫性疾病的自体多模块Treg细胞候选疗法。这些疗法有可能治愈I型糖尿病(T1D)和炎症性肠病(IBD)。此外,Quell将保留其主要Treg细胞治疗候选药物QEL-001的全部所有权以及正在进行的神经炎症临床前项目。
T细胞是免疫系统中的控制前线,Treg负责抑制免疫应答。简单来说,Treg能够通过“踩刹车”来下调免疫系统,防止过度活跃并因此产生病理性免疫反应。Quell正在采用专利和创新技术来开发Treg细胞治疗技术。(动脉新医药)

CAT-Treg细胞治疗原理
有望成为首款!NASH突破性疗法完成新药申请递交
2023年7月18日,Madrigal Pharmaceuticals宣布,已经完成向美国FDA滚动提交Resmetirom的新药申请,用于治疗伴肝纤维化的非酒精性脂肪性肝炎(NASH)成人患者,该疾病尚无获批疗法。Madrigal已要求对Resmetirom的NDA进行优先审评。该疗法此前获得美国FDA授予突破性疗法认定。
NASH是非酒精性脂肪性肝病(NAFLD)的更晚期形式。据估计,全球超过20%的成年人患有NAFLD。NASH是导致肝脏相关死亡的主要原因,对全球卫生系统造成日益加重的负担。此外,NASH患者,特别是那些具有更多代谢风险因素(高血压、合并2型糖尿病)的患者,心血管不良事件的风险增加,发病率和死亡率也相应提高。一旦NASH发展为显著的肝纤维化(F2和F3阶段),患者产生不良肝损伤结果的风险急剧上升。
Resmetirom是一种每日一次、口服、甲状腺激素受体(THR)-β选择性激动剂,旨在靶向NASH的关键基础病因。甲状腺激素通过激活肝细胞中的β受体,在肝功能中发挥核心作用,影响从血清胆固醇和甘油三酯水平,到肝脏中脂肪病理性积聚等一系列健康参数。THR-β受体在肝脏中的作用是肝脏正常功能的关键。Resmetirom具有高选择性,能够避免激活介导肝脏外(包括心脏和骨骼)甲状腺激素活性的THR-α受体,并且在肝脏部位被特异性摄取。之前的试验证实Resmetirom的安全性,即对THR-α受体无活性,对骨骼或心脏参数无影响,同时不影响甲状腺激素通路的其它激素。(药明康德)
渐冻症新药!首款靶向SOD1突变反义核苷酸疗法在华申报上市
2023年7月14日,国家药监局药审中心(CDE)官网显示,渤健的托夫生注射液(Tofersen)上市申请获受理。
2023年4月25日,美国FDA加速批准反义寡核苷酸疗法Tofersen上市(商品名:Qalsody ),用于治疗超氧化物歧化酶1(SOD1)突变所致的肌萎缩侧索硬化(ALS)患者。这是首款针对ALS的基因靶向疗法。
ALS,俗称渐冻症,是一种进行性神经退行性疾病,临床主要表现为进行性发展的骨骼肌萎缩、无力、肌束颤动,患者生存时间平均为3-5年,最常见的死因是呼吸衰竭。SOD1-ALS是ALS的一种罕见遗传性形式,仅占全球约16.8万ALS病例的2%,大多患者疾病进展迅速,发病后生存期不超过3年。
Tofersen由渤健与Ionis共同开发,是一种用于治疗SOD1-ALS的反义寡核苷酸药物。Tofersen可与编码SOD1的mRNA结合,使其被核糖核酸酶降解,从而减少SOD1蛋白的产生。(医药魔方)
莱芒生物与优赛诺生物达成全面战略合作
近日,免疫代谢创新药物研发企业莱芒生物宣布,与优赛诺生物签署全面战略合作协议。双方将积极探索免疫代谢重编程技术(Meta 10)在通用型CAR-T中的应用转化能力,共同研发“极低剂量”的“现货型”血液瘤CAR-T细胞治疗产品,携手推动细胞治疗产业发展。
莱芒生物的代谢重编程技术(Meta 10)是国际领先的抗T细胞耗竭的创新技术。大量研究证实Meta 10可以激活终末耗竭T细胞的氧化磷酸化代谢,从而恢复终末耗竭T细胞的增殖潜能和杀伤活性。前期研究结果显示在小鼠皮下肿瘤模型、肺癌转移模型以及NSG人源肿瘤模型中展示出卓越的肿瘤清除能力,并具有诱导干性免疫记忆细胞形成和预防肿瘤复发的效果。由Meta 10赋能的代谢增强型CD19 CAR-T的IIT临床研究正在顶级医疗机构开展。目前首批入组的三位患者均以极低剂量(常规用药剂量的5%)实现完全响应(CR)。而且,在治疗过程中患者体征平稳可控,未发现细胞因子风暴、神经毒性等常见副作用,显示出Meta 10巨大的临床应用前景。
优赛诺生物专注于异体通用型CAR-T产品的研发和产业化。首个产品UC101作为全球领先的脐血来源通用型CAR-T细胞治疗产品,已在IIT临床研究中展现出对急性B淋巴细胞性白血病患者良好的治疗效果。后续将针对多种肿瘤开发针对性的治疗产品。
莱芒生物的Meta 10技术有望解决免疫治疗过程中T细胞耗竭的难题,提升肿瘤患者对免疫细胞药物的应答率和治愈率。此次莱芒生物和与优赛诺生物的合作,将强化异体通用型CAR-T对肿瘤细胞的杀伤作用,提升产品对肿瘤的治愈潜力。(莱芒生物)
临床应用
启函生物多位点基因编辑细胞产品获中国CDE临床试验默示许可
2023年7月18日,启函生物,一家致力于将高通量基因编辑技术应用于细胞治疗和器官移植领域的生物科技公司,宣布其产品QN-019a的临床试验申请已获得国家药监局(NMPA)的临床试验默示许可,这是中国第一个获批的基因编辑iPSC来源的细胞治疗产品。
启函生物运用多位点基因编辑技术修改人源多能诱导干细胞(iPSC),并将其分化成为靶向CD19阳性B细胞肿瘤的自然杀伤细胞(NK)产品QN-019a,其临床适应症为CD19阳性的复发难治性侵袭性B细胞非霍奇金淋巴瘤。(启函生物)

国内首款复制缺陷型猴痘疫苗获中国CDE受理
2023年7月13日,国家药监局药审中心(CDE)官网显示,北京生物制品研究所有限责任公司递交的复制缺陷型猴痘疫苗临床试验申请已获受理。
猴痘是一种由猴痘病毒(Monkeypox virus,MPXV)感染所致的人兽共患病毒性疾病,临床上主要表现为发热、皮疹、淋巴结肿大。
根据国家卫健委发布的《猴痘诊疗指南(2022年版)》显示,猴痘病毒归类于痘病毒科正痘病毒属,是对人类致病的4种正痘病毒属之一(另外3种是天花病毒、痘苗病毒和牛痘病毒),其传播途径为:1)病毒经黏膜和破损的皮肤侵入人体;2)人主要通过接触感染动物病变渗出物、血液、其它体液,或被感染动物咬伤、抓伤而感染;3)人与人之间主要通过密切接触传播,也可通过飞沫传播,接触被病毒污染的物品也有可能感染,还可通过胎盘垂直传播。尚不能排除性传播。
猴痘为自限性疾病,目前国内尚无特异性抗猴痘病毒药物,也未有专门针对猴痘病毒开发的特异性疫苗,但此前针对天花的疫苗能够起到交叉保护的作用。(药通社)

天泽云泰基因疗法VGM-R02b获批临床
2023年7月13日,天泽云泰自主研发的VGM-R02b获得国家药监局(NMPA)批准同意开展治疗戊二酸血症I型(GA-I)的临床试验。
GA-I是一种罕见的遗传性代谢疾病,因编码戊二酰辅酶A脱氢酶(GCDH)的基因突变导致GCDH活性降低或缺陷,导致赖氨酸、羟赖氨酸和色氨酸代谢障碍,代谢产物戊二酸、3-羟基戊二酸在体内异常蓄积,引起以神经系统为主的多脏器损害。多在婴幼儿期发病,常在感染、高蛋白饮食或预防接种等应激刺激后诱发急性脑病危象,危及生命。
VGM-R02b是一种防止婴幼儿及儿童期GA-I造成严重或危及生命的疾病进展的潜在治疗方法,也是全球首个用于GA-I的基因治疗产品。2022年5月25日获得美国FDA授予其用于治疗GA-I的罕见儿科疾病认定(RPDD)资格。这也是天泽云泰成立以来的第三个获得临床许可的基因治疗项目。(天泽云泰)

沙砾生物基因编辑型TIL产品获得中国CDE临床试验许可
2023年7月12日,国家药监局药审中心(CDE)官网显示,沙砾生物自主研发的GT201注射液(受理号:CXSL2300290)正式获得CDE的临床试验默示许可。
GT201是沙砾生物自主研发的表达膜结合细胞因子的下一代基因编辑型TIL(肿瘤浸润淋巴细胞)产品。沙砾研发团队在临床前研究中对比和选择了最优化的结构设计,并为工程化TIL疗法量身定做了逆转录病毒系统StaViral®,可实现在多批次、不同瘤种来源的TIL细胞稳定表达目标基因。(沙砾生物)
先声药业引进的失眠症新药获批临床
2023年7月20日,先声药业宣布,其与Idorsia合作的失眠症药物盐酸Daridorexant片已获得国家药监局(NMPA)签发的药物临床试验批准通知书,拟用于治疗症状持续存在至少3个月且对日间功能产生影响的成人失眠患者。
Daridorexant是一种双重食欲素受体拮抗剂(DORA),可阻断促进觉醒的食欲素神经肽(食欲素A和食欲素B)与其受体结合,与一般通过镇静大脑来促进睡眠不同,Daridorexant仅阻断食欲素神经肽对食欲素受体的激活。因此,Daridorexant减少唤醒驱动,诱导睡眠发生,而不改变睡眠结构。
Daridorexant除可改善慢性失眠障碍成年人群的夜间睡眠外,还可改善患者的日间功能,是唯一一款获得欧洲药品监督管理局(EMA)批准的改善日间功能的DORA类失眠药物。目前,Daridorexant已于美国、英国、意大利、德国、瑞士、加拿大获批上市。(医药魔方)
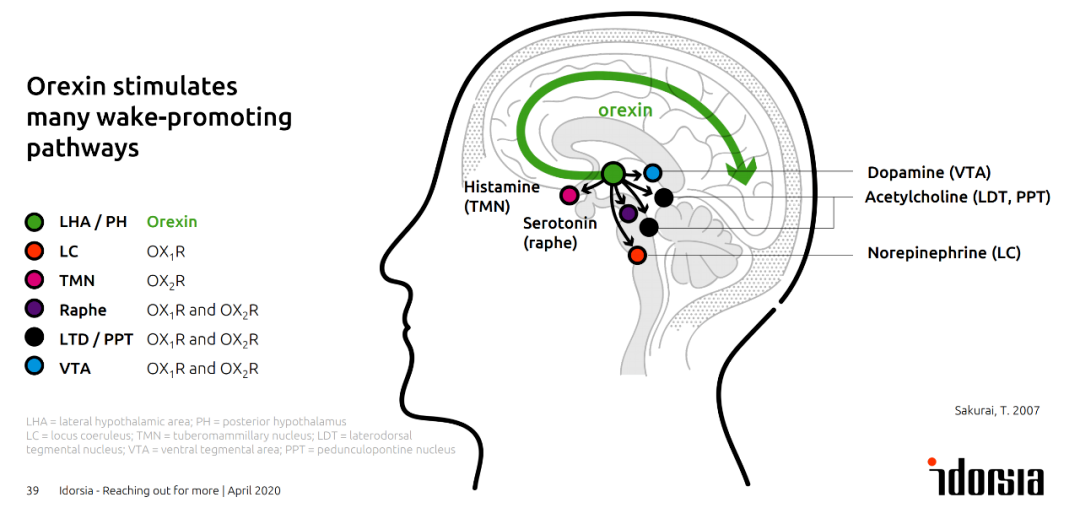
食欲素刺激多条促觉醒的信号通路