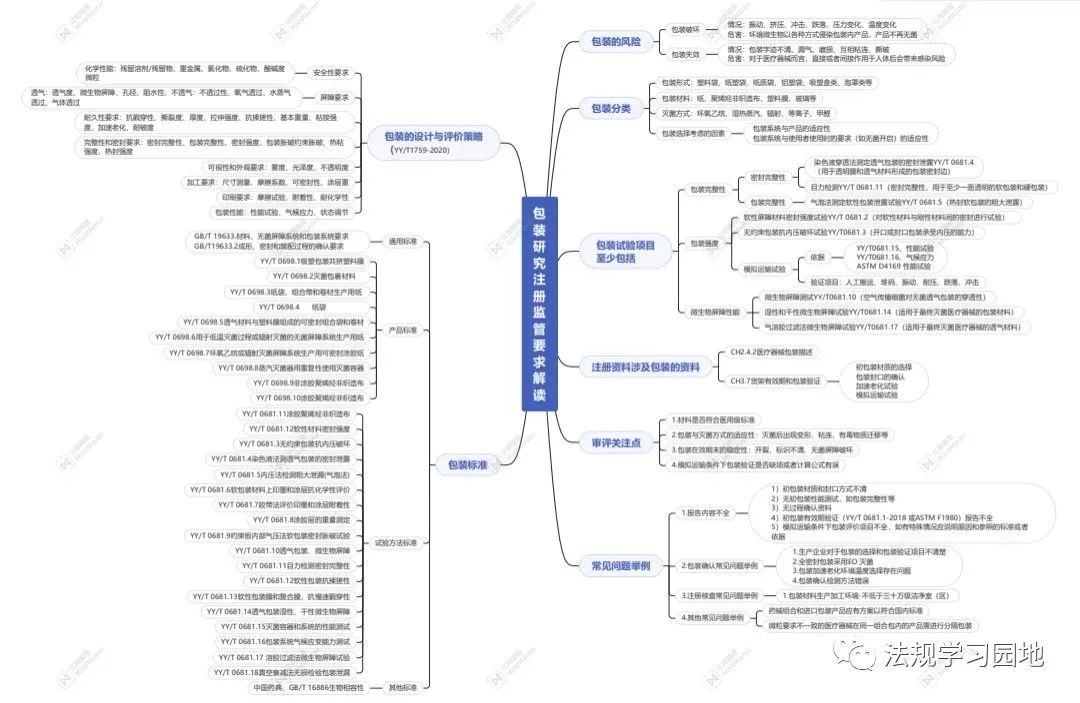
一张图带您了解无菌医疗器械包装的注册监管要点。包装的意义是什么?包装怎么分类?设计开发阶段选择包装时要考虑哪些要求?包装研究易参考的标准有哪些?注册资料中涉及包装的资料有哪些?包装研究最少测试哪些项目?以及审评关注点和常见问题是什么?
一、包装的意义
无菌医疗器械包装,为产品提供无屏障系统保证产品不被污染,包装破坏或者失效,都有可能让产品带菌,导致患者感染。

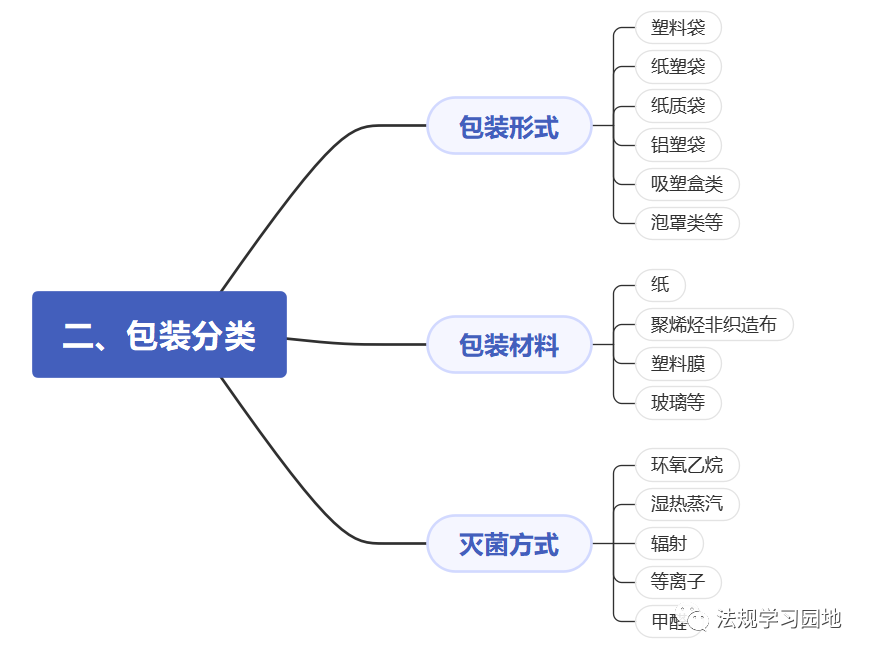
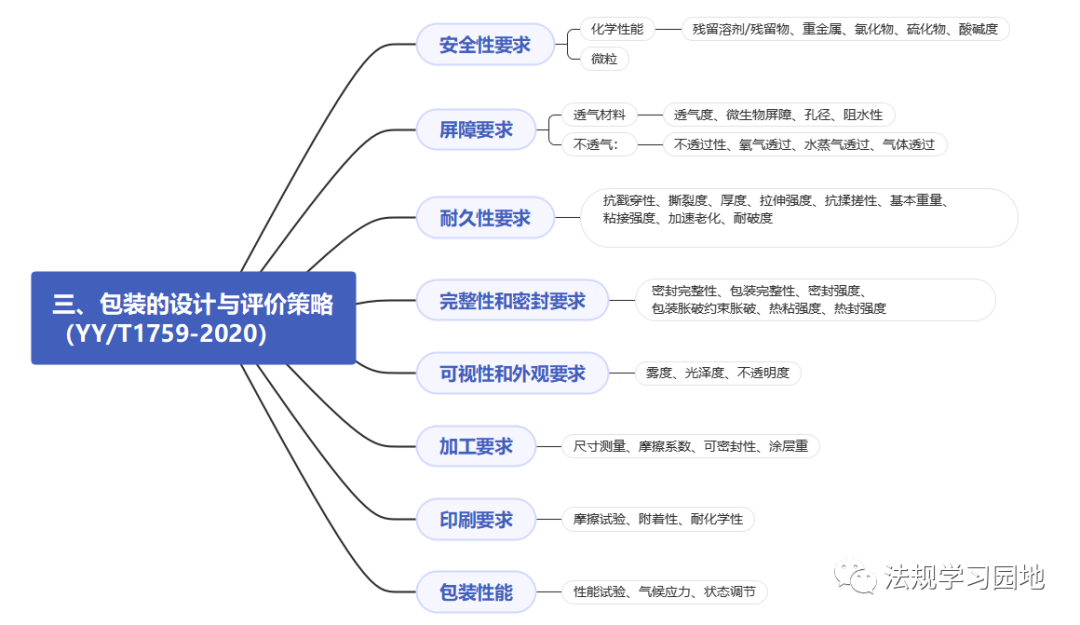
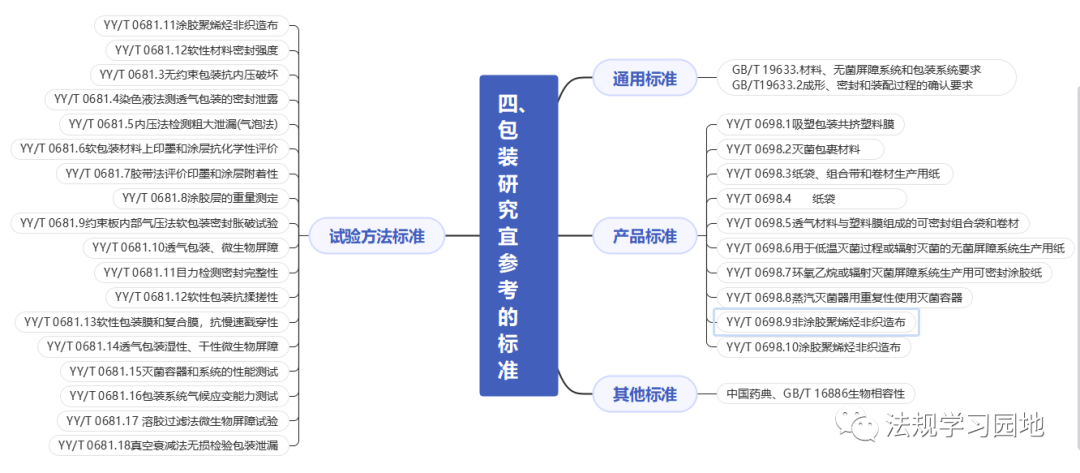
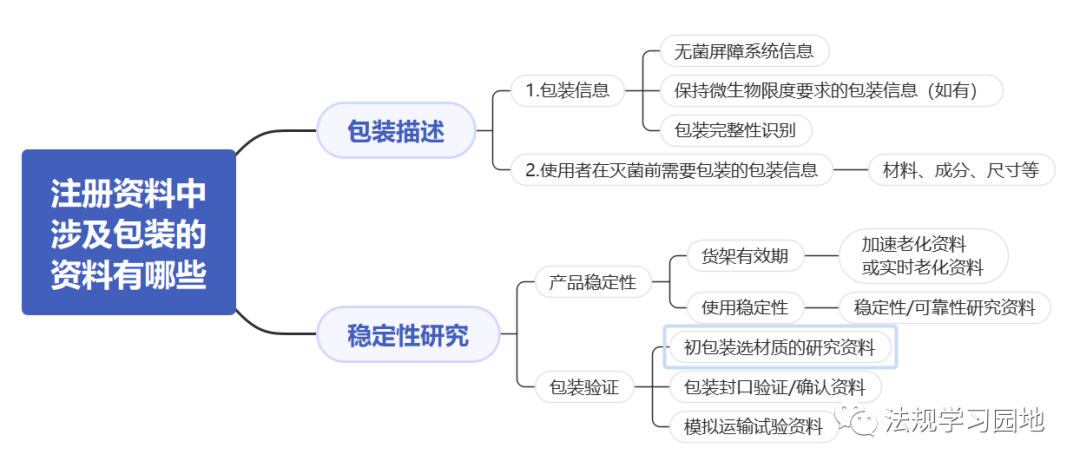
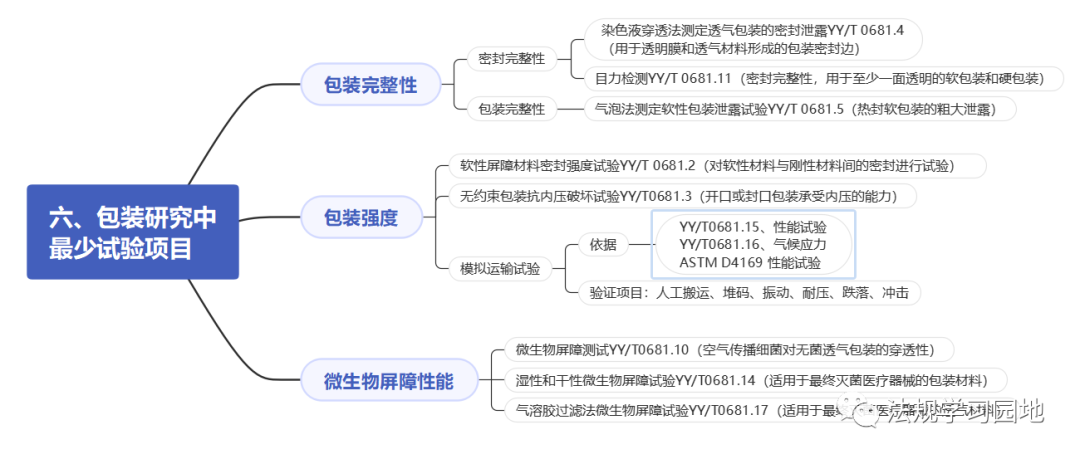
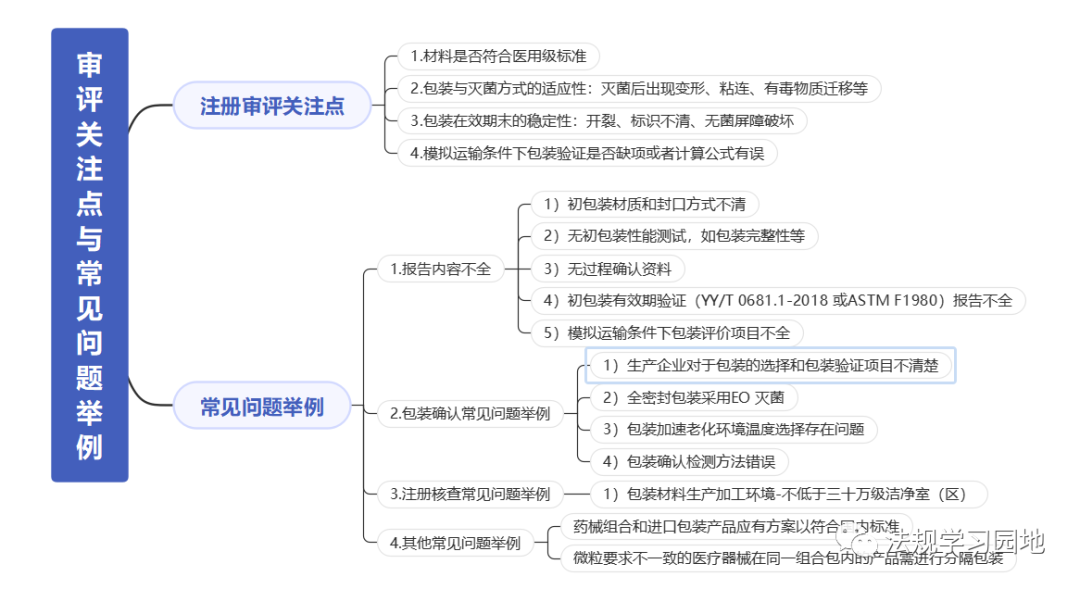
一张图带您了解无菌医疗器械包装的注册监管要点。包装的意义是什么?包装怎么分类?设计开发阶段选择包装时要考虑哪些要求?包装研究易参考的标准有哪些?注册资料中涉及包装的资料有哪些?包装研究最少测试哪些项目?以及审评关注点和常见问题是什么?

一、包装的意义
无菌医疗器械包装,为产品提供无屏障系统保证产品不被污染,包装破坏或者失效,都有可能让产品带菌,导致患者感染。






