食品污染物检测——减少食源性病原体对人类健康的影响
食源性病原体检测
目前,食源性病原体对人类生命健康构成巨大威胁,给整个社会造成巨大经济损失。根据世界卫生组织的报告,全球每年有6亿人(几乎十分之一)因食用受污染的食物而患病,每年约有42万人死亡,导致3300万健康生命年(DALY)的损失。此外,5岁以下儿童承担了40%的食源性疾病负担,每年有125 000人死亡,因此开发一种实时检测食源性病原体的方法是十分有必要的。食源性病原体包含不同类型,如病毒、细菌、真菌和寄生虫。最常见的食源性病原体是李斯特菌、霍乱弧菌、沙门氏菌、大肠杆菌和金黄色葡萄球菌。食源性病原体引起的疾病通常伴随着不舒服的反应,如腹泻、腹痛、溶血性尿毒症、发烧、呕吐,严重时可能导致死亡。例如大肠杆菌O157:H7所导致的疾病,发病率达到了10%,死亡率达到了3-5%。值得我们注意的是,许多致病病原体的感染剂量非常低。例如,大肠杆菌O157:H7和沙门氏菌的感染剂量分别低至约50个细胞和103CFU/mL,这使得人们很容易被感染。因此,有必要开发快速、准确、灵敏的食品污染物检测方法,以减少食源性病原体对人类健康的影响。
食源性病原体检测有几种方法,如基于培养的方法、生物化学方法、流式细胞术和PCR,这些方法被称为金标准方法。尽管他们的结果是准确的,但他们仍然面临着分析时间长和通量低的缺点,通常需要仪器和训练有素的技术人员。因此,它不适合现场快速检测。为了解决这些问题,出现了许多新的核酸检测技术,如逆转录聚合酶链式反应(RT-PCR)、环介导等温扩增(LAMP)、酶联免疫吸附测定(ELISA)等。基于抗原和抗体之间的免疫反应的酶联免疫吸附试验,由于其特异性、速度和高通量能力而经常用于食品分析。然而,它经常受到抗体来源有限、灵敏度不足和交叉污染的影响。此外,食品中常见的病原体数量相对较少,需要对样品进行预处理,以减少对食品基质的干扰,提高检测灵敏度。由于食品基质的复杂性,许多方法需要训练有素、经验丰富的操作员和昂贵的设备来处理样本,为劳动密集型,需要消耗大量的人力物力,就导致了不太适合现场检测。
01 CRISPR/Cas12a系统
规律间隔成簇短回文重复序列及其相关核酸酶(CRISPR/Cas)系统是一种细菌以及古细菌用于对抗外来核酸入侵的适应性免疫系统。经过多年的探索,CRISPR/Cas 技术已经广泛应用于基因编辑、转录调节、基因成像以及体外诊断等诸多领域。在体外诊断应用方面,CRISPR/Cas系统能够对短序列核酸靶标进行精准识别。对于CRISPR/Cas12a,可在精准识别并切割对应靶标核酸序列的同时,能够发挥反式切割活性,在37℃恒温条件下,可以分别对单链DNA(ssDNA)报告探针进行高效的酶切作用。在核酸扩增体系当中,CRISPR/Cas12a等基因编辑技术可以有效地表征食源性病原体,与传统检测方法相比,反应迅速,特异性高,不易出现假阳性。然而,它的信号放大率不高,经常需要与核酸扩增方法相结合。
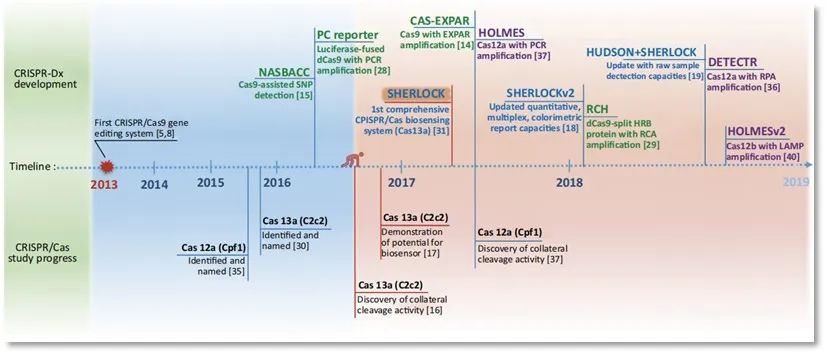
图1 | CRISPR技术的研究发展历程
02 核酸扩增方法
核酸扩增方法是一种重要的分子生物学技术,它可以在体外扩增DNA或RNA分子,从而使其数量增加到足够的程度,以便进行进一步的研究。在该项课题研究中,核酸扩增方法主要包括基于有酶介导核酸扩增方法和基于无酶介导核酸扩增方法。基于有酶介导核酸扩增方法主要包括基于重组酶聚合酶扩增 (RPA)方法、基于分支滚环(RCA)扩增方法、基于重组酶辅助扩增 (RAA)方法等。此类方法存在一定的局限性,比如需要重组酶、聚合酶等蛋白质,存在潜在的携带污染;而且操作繁琐,酶类蛋白质保存条件苛刻,不易保存;基于无酶介导核酸扩增方法主要包括基于催化发夹自组装 (CHA)方法、基于杂交链式反应 (HCR)方法等,其不仅仅有高的捕获分析物的效率和良好信号放大效果,而且不需要酶,操作简便,选择性多。因此,利用无酶核酸扩增联用基因编辑技术 (CRISPR/Cas12a)的形式来检测食源性病原体是一种新型且有效的新思路。其中,CHA反应的核心思路是通过精妙的核酸序列设计,设计单链的S链和形成茎环结构的H1链、H2链来形成dsDNA产物。在CHA反应当中,S链约为20-28 bp,为催化剂作用,H1、H2链长度不一,大约在40-65bp左右。S首先会与H1的“长臂”区域互补配对,打开H1链,形成S/H1中间体复合物,该复合物会与H2链配对,形成双链DNA产物,释放S链,S链再参与下一个CHA反应,以此为一个循环,产生大量CHA双链DNA产物(图1-2)。整个CHA反应过程中没有聚合酶的出现,为无酶扩增,通过巧妙的序列设计,通过化学键“打开、合成”的能量变化形成产物。
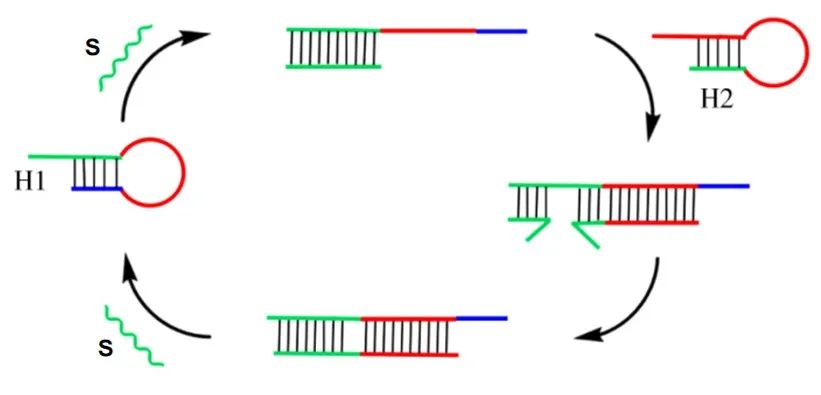
图2 | CHA反应原理图
03 CHA-CRISPR/Cas12a技术及其在靶标检测中的应用
CHA与CRISPR技术的联用可以互为补充,实现多级信号放大,有良好的应用前景。但最近用CRISPR方法联用催化发夹组装的研究主要集中在检测和分析微小RNA等小生物标志物的领域。同样的,传统的miRNA检测方法,如寡核苷酸微阵列、northern印迹和定量RT-PCR,由于使用精确的设备,具有一些缺点,如耗时和成本高。利用CRISPR方法对CHA反应进行表征,其灵敏、快速、经济高效的特性引起了人们的极大兴趣,将其应用于各个领域,尤其是疾病预防。有研究分析了某些病毒的存在,如新型冠状病毒(严重急性呼吸系统综合征冠状病毒2型)。然而,近年来,有关利用CHA与CRISPR联合检测病原微生物的论文相当有限,以检测其他靶标来讲述CHA-CRISPR/Cas12a技术的研究进展。
微小RNA(miRNA)是一种非编码的小RNA分子,由于其与许多生物过程有关,可以作为不同类型疾病的敏感生物标志物。miRNA的异常表达可能与癌症疾病的发生有关,因此,开发一种快速和特异性的miRNA检测方法在早期临床诊断和治疗中具有巨大的应用潜力。Peng等人将CRISP-Cas12a与CHA整合用于检测微小RNA。CRISP-Cas 12a的使用是由于其在切割作用中的高效性,每秒约有1250次。CHA电路设计用于将每个靶分子转化并扩增为多个可编程DNA双链体。双链体的原间隔区相邻基序(PAM)和原间隔区序列可以被Cas12a/gRNA复合物识别,随后启动CRISPR-Cas12对荧光ssDNA的反式切割作用,从而产生荧光信号(图1-3)。该方法有两个重要突破。第一个是由于在DNA双链输出中引入了不成对的位点,CRISPR-12a的侧支切割介导的信号扩增增强。第二个是它可以通过修饰CHA模块中的可变区来实现对不同miRNA生物标志物的灵敏检测。其他研究证明了这一点,通过使用CRISPR-Cas12和CHA,用不同的miRNA(如miR-21、miR-141和miR-144)实现了等温检测,结果明显优于使用基于Cas13a的方法。
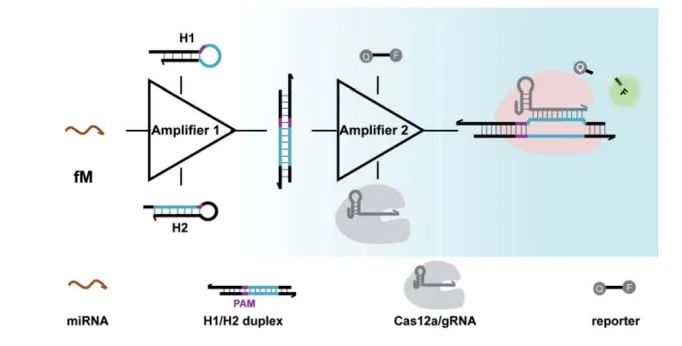
图3 | CRISPR-CHA方法扩增检测miRNA的工作原理
04 微流控芯片在病原微生物检测当中的应用
微流控(Microfluidics)指的是使用微管道(尺寸为数十到数百微米)处理或操纵微小流体(体积为纳升到阿升)的系统所涉及的科学和技术,是一门涉及化学、流体物理、微电子、新材料、生物学和生物医学工程的新兴交叉学科。因为具有微型化、集成化等特征,微流控装置通常被称为微流控芯片,也被称为芯片实验室(Lab on a Chip)和微全分析系统(micro-Total Analytical System)。微流控的重要特征之一是微尺度环境下具有独特的流体性质。借助这些独特的流体现象,微流控可以实现一系列常规方法所难以完成的微加工和微操作。目前,微流控被认为在生物医学研究中例如病原体检测,具有巨大的发展潜力和广泛的应用前景。
目前,微流控芯片主要有基于连续流体的微流控芯片、基于液滴的微流控芯片、纸基微流控芯片、数字化微流控芯片、可编程式微流控芯片和模块化微流控芯片。
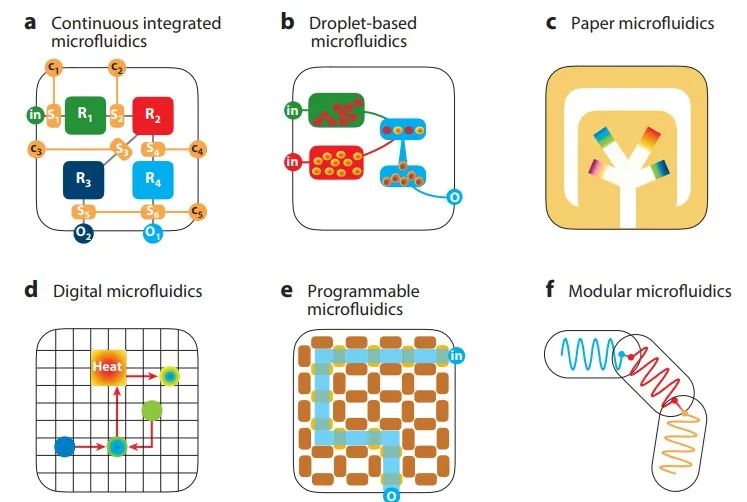
图4 | 微流控芯片的种类
其中,基于连续流体的微流控芯片,其主要通过在封闭的机械通道内的连续的流体进行操控,也是微流控芯片当中最为常见的。在Sun等人的研究中,先前通过NUPACK软件包预测和设计了三种不同类型的发夹寡聚结构(H1-1、H1-2、H1-3),以获得与S-DNA链结合效率最高的最佳发夹结构(H1-3)。再通过连续流体的微流控芯片作为载体平台,利用细菌竞争性结合触发催化发夹组装(CHA)和HRP-Au-NPs催化的CL反应来实现多信号扩增。基于该平台,目标细菌的检测转化为核酸的检测,检测极限低至130CFU/mL。
微流控技术凭借它易操作、试剂消耗量少、短的检测时间、可以并行检测、同时具备集成化和自动化等优点而逐步应用于食源性病原体的检测当中,其可集成化的特点也可以很好的集成上述的CHA反应以及CRISPR/Cas12a,并作为平台来一体化检测大肠杆菌O157:H7和金黄色葡萄球菌。
05 基于微流控芯片的信号检测方法
在食品样品分析中,病原体通常存在于复杂的基质中。微流控技术提供了一种强大的工具,可以集成分离和检测过程,实现病原体的快速、自动化和高通量分析。许多信号放大策略也被用来提高检测灵敏度,特别是当目标浓度非常低时。几十年来,通过使用不同的信号转导策略,开发了大量基于微流体的生物传感器用于食源性病原体的检测。在这里,我们主要关注通过比色法、荧光法、化学发光法和质谱法(MS)检测的方法。
关于比色传感器,该传感器依赖于基于化学反应的颜色变化,由于其易于操作和简单的信号读出,因此对于POCT来说是可取的。研究人员开发了大量基于不同基质和催化剂的微流控比色生物传感器。在催化剂中,辣根过氧化物酶(HRP)具有较高的催化活性,常被用作显色反应的催化剂,如催化H2O2与多种底物之间的氧化还原反应,产生比色输出信号,对目标物质进行定量。将荧光技术集成到微流体平台中,以其快速、准确、高灵敏度被广泛应用于食源性病原体检测。荧光生物传感器将目标信号转换为荧光强度。大多数用于病原体检测的荧光生物传感器是基于抗原和抗体之间或特定适体和目标细菌之间的免疫反应。
对于化学发光法(Chemi Luminescence,CL),CL是一种基于鲁米诺H2O2系统或其他化学反应发光的技术。CL技术由于其反应快、检测灵敏度低、背景低、操作简单等明显优点,被认为是一种强大而重要的分析方法,显示出器件小型化的巨大潜力。到目前为止,已经开发了大量基于微流体的CL生物传感器来检测小分子、蛋白质、核酸和细菌。质谱(Mass Spectrometry,MS)是一种强大的无标记技术,可以提供分子量信息,是应用于各个领域的最常用的分析工具之一。与PCR等其他分子诊断方法相比,MS为细菌鉴定提供了几个明显的优势,如低成本、高质量分辨率和多组分分析。其中,荧光检测当中所需样品用量少及操作简便,可以直接读出信号;拥有高的检测灵敏度;荧光检测过程当中干扰程度低、通量高;实验设计上,可以将ssDNA将荧光集团连接起来,倘若有靶标病原体,crRNA可以激活Cas12a的反式切割活性,切断ssDNA,淬灭荧光集团,发出荧光检测信号。
结语
在飞速发展的当代社会当中,人类健康被放到了越来越重要的位置。“民以食为天”,其中食品安全尤为突出,而食源性病原体又是造成食品安全最主要的原因之一。本文简要论述了食源性病原体的危害以及部分可以检测食源性病原体的方法,相信随着科学技术研究,可以真正做到“病不从口入”,对此,我们为构建大健康贡献绵薄之力!
图文 | 张新瑞
排版 | 王语湘
审核 | 杜秉航 张翀昊
文章仅代表作者观点,本文首发于灏真科普谈,转载请注明公众号出处
审核 | 郝治翰 安栩瑶 敏杰 李亚芳