第 7 з« пјҡдәІж ёеҸ–д»ЈеҸҚеә”
жңүдәҶжңүжңәеҢ–еӯҰеҹәжң¬жҰӮеҝөзҡ„еҹәзЎҖпјҢжҲ‘们зҺ°еңЁеҮҶеӨҮеҘҪеӯҰд№ жңүжңәеҸҚеә”дәҶгҖӮжңүжңәеҸҚеә”дё»иҰҒжҳҜдёҖз§Қе®ҳиғҪеӣўеҗ‘еҸҰдёҖз§Қе®ҳиғҪеӣўзҡ„иҪ¬еҢ–пјҢе…¶зӣ®зҡ„жҳҜе°Ҷж–°зҡ„е®ҳиғҪеӣўеј•е…ҘеҲ°дә§зү©дёӯгҖӮдҪңдёәеҢ–еҗҲзү©зҡ„еҸҚеә”дёӯеҝғпјҢе®ҳиғҪеӣўе…·жңүзӢ¬зү№зҡ„жҖ§иҙЁе№¶еҸ‘з”ҹжҹҗдәӣзұ»еһӢзҡ„еҸҚеә”гҖӮжҲ‘们е°ҶжҺўзҙўжҺ§еҲ¶жҜҸдёӘе®ҳиғҪеӣўеҸҚеә”жҖ§зҡ„е…·дҪ“规еҲҷпјҢ并дәҶи§Јдёәд»Җд№ҲдёҚеҗҢе®ҳиғҪеӣўиЎЁзҺ°еҮәдёҚеҗҢзҡ„еҸҚеә”жҖ§гҖӮеңЁжң¬з« дёӯпјҢжҲ‘们е°Ҷд»ҺеҚӨд»Јзғ·зҡ„еҸ–д»ЈеҸҚеә”ејҖе§ӢпјҢ并иҝӣдёҖжӯҘз ”з©¶гҖӮ
7.1 дәІж ёеҸ–д»ЈеҸҚеә”жҰӮиҝ°
и®©жҲ‘们д»ҺдёҖдёӘз®ҖеҚ•зҡ„еҸ–д»ЈеҸҚеә”зӨәдҫӢејҖе§Ӣпјҡ
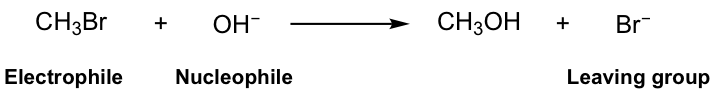
еӣҫ7.1a еҸ–д»ЈеҸҚеә”
еңЁиҜҘеҸҚеә”дёӯпјҢеҸҚеә”зү©з”ІеҹәжәҙпјҲCH 3 Brпјүдёӯзҡ„Brиў«OHеҹәеӣўеҸ–д»ЈпјҢз”ІйҶҮпјҲCH 3 OHпјүжҳҜдё»иҰҒдә§зү©пјҢеҗҢж—¶иҝҳжңүжәҙеҢ–зү©Br -пјҢеүҜдә§е“ҒгҖӮеҫҲе®№жҳ“зҗҶи§ЈиҝҷжҳҜдёҖдёӘеҸ–д»ЈеҸҚеә”пјҢеӣ дёәBrиў«OHеҸ–д»ЈдәҶгҖӮ
еҜ№иҝҷдёӘз®ҖеҚ•еҸҚеә”зҡ„иҝӣдёҖжӯҘи®Ёи®әйңҖиҰҒеј•е…ҘдёҖдәӣе…ій”®жңҜиҜӯпјҢиҝҷдәӣжңҜиҜӯеҜ№дәҺзҗҶи§ЈеҸҚеә”дёәдҪ•д»ҘеҸҠеҰӮдҪ•д»Ҙиҝҷз§Қж–№ејҸиҝӣиЎҢиҮіе…ійҮҚиҰҒгҖӮиҝҷдәӣжңҜиҜӯжҳҜдәІз”өеӯҗиҜ•еүӮгҖҒдәІж ёиҜ•еүӮе’ҢзҰ»еҺ»еҹәеӣўгҖӮ
дәІз”өдҪ“
еҸҚеә”зү©CH 3 BrжҳҜзғ·еҹәеҚӨгҖӮзғ·еҹәеҚӨеҢ–зү©дёӯзҡ„ C-X й”®пјҲXпјҡFгҖҒCl е’Ң BrпјүжҳҜжһҒжҖ§зҡ„пјҢеӣ дёәеҚӨзҙ жҜ”зўіжӣҙе…·иҙҹз”өжҖ§пјҢеӣ жӯӨзўіе…·жңүйғЁеҲҶжӯЈз”өиҚ·пјҢиҖҢеҚӨзҙ е…·жңүйғЁеҲҶиҙҹз”өиҚ·гҖӮ
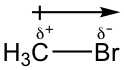
з”ұдәҺзўідёҠеёҰжңүйғЁеҲҶжӯЈз”өиҚ·пјҢC-Xй”®дёӯзҡ„зўіеҺҹеӯҗзјәз”өеӯҗпјҢйңҖиҰҒеҜ»жүҫеҜҢз”өеӯҗиҜ•еүӮдёҺд№ӢиҝһжҺҘгҖӮиҝҷз§Қзјәз”өеӯҗзҡ„зү©з§Қиў«з§°дёәдәІз”өеӯҗзү©з§ҚпјҲphileжҳҜеёҢи…ҠиҜӯеҗҺзјҖпјҢж„ҸдёәвҖңзҲұвҖқпјҢиЎЁжҳҺе®ғжҳҜдёҖз§Қе–ңзҲұз”өеӯҗзҡ„зү©з§ҚпјүгҖӮзјәз”өеӯҗзү©иҙЁйҖҡеёёжҳҜдәІз”өеӯҗзү©иҙЁгҖӮе…¶д»–дәІз”өдҪ“е®һдҫӢеҢ…жӢ¬еёҰжӯЈз”өзҡ„зҰ»еӯҗе’Ңе…·жңүдёҚе®Ңж•ҙе…«дҪҚз»„зҡ„еҺҹеӯҗпјҢдҫӢеҰӮпјҡH + гҖҒCH 3 + гҖҒBH 3 гҖҒ BeF 2 е’Ң AlCl 3 гҖӮ
еҜ№дәҺиҜҘеҸҚеә”дёӯзҡ„CH 3 Br жқҘиҜҙпјҢе……еҪ“дәІз”өеӯҗиҜ•еүӮзҡ„жҳҜзўіеҺҹеӯҗпјҢиҝҷз§ҚзўіеҸҜд»Ҙз§°дёәдәІз”өеӯҗзўігҖӮ
еҸ‘з”ҹеҸ–д»Јзҡ„еҢ–еҗҲзү©CH 3 BrйҖҡеёёеҸҜз§°дёәеә•зү©гҖӮ
дәІж ёиҜ•еүӮ
ж°ўж°§еҢ–зү©OH вҖ“ жҳҜдёҠиҝ°еҸҚеә”дёӯзҡ„еҸҰдёҖз§ҚеҸҚеә”зү©гҖӮз”ұOH вҖ“ зҡ„и·Ҝжҳ“ж–Ҝз»“жһ„жё…жҘҡең°иЎЁжҳҺпјҢж°§еҺҹеӯҗе…·жңүдёүдёӘеӯӨеҜ№з”өеӯҗпјҢдё”еёҰиҙҹз”өпјҢеӣ жӯӨжҳҜдёҖз§Қе…·жңүй«ҳз”өеӯҗеҜҶеәҰзҡ„еҜҢз”өеӯҗзү©з§ҚгҖӮ
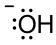
еҜҢз”өеӯҗзү©иҙЁз§°дёәдәІж ёиҜ•еүӮпјҲвҖңж ёвҖқжқҘиҮӘеҺҹеӯҗж ёпјҢж„Ҹе‘ізқҖжӯЈз”өиҚ·пјүпјҢе®ғжҳҜдёҖз§ҚеҜ»жұӮдёҺеёҰжӯЈз”өжҲ–зјәз”өеӯҗзү©иҙЁеҸ‘з”ҹеҸҚеә”зҡ„иҜ•еүӮгҖӮ OH вҖ“ жҳҜдёҠиҝ°еҸҚеә”зҡ„дәІж ёиҜ•еүӮгҖӮдёҖиҲ¬жқҘиҜҙпјҢд»»дҪ•е…·жңүеҸҜе…ұдә«з”өеӯҗеҜ№зҡ„зү©иҙЁйғҪеҸҜд»ҘжҳҜдәІж ёиҜ•еүӮгҖӮдәІж ёиҜ•еүӮеҸҜд»ҘеёҰиҙҹз”ө (Nu: вҖ“ ) жҲ–дёӯжҖ§ (Nu:)пјҢдҫӢеҰӮпјҡ OR вҖ“ гҖҒ H 2 OгҖҒROHгҖҒ NH 3 гҖҒRNH 2 е’Ң RCOO вҖ“ йғҪжҳҜеҸҜиғҪзҡ„дәІж ёиҜ•еүӮгҖӮ
еҹәдәҺеҜ№дәІз”өиҜ•еүӮе’ҢдәІж ёиҜ•еүӮжҰӮеҝөзҡ„зҗҶи§ЈпјҢжӮЁеҸҜиғҪе·Із»Ҹж„ҸиҜҶеҲ°дәІж ёиҜ•еүӮеҸҜд»ҘдёҺдәІз”өиҜ•еүӮеҸ‘з”ҹеҸҚеә”пјҒжҳҜзҡ„пјҢиҝҷжҳҜжңүжңәеҸҚеә”зҡ„дёҖдёӘйқһеёёйҮҚиҰҒе’Ңеҹәжң¬зҡ„规еҲҷпјҡеҪ“еҜҢз”өеӯҗдәІж ёиҜ•еүӮдёҺзјәз”өеӯҗдәІз”өиҜ•еүӮзӣёйҒҮж—¶пјҢе°ұдјҡеҸ‘з”ҹжңүжңәеҸҚеә”гҖӮ
зҰ»ејҖйӣҶеӣў
дёәдәҶзЎ®дҝқдёҠиҝ°еҸ–д»ЈеҸ‘з”ҹпјҢеҸҰдёҖдёӘе…ій”®еӣ зҙ жҳҜBrеҝ…йЎ»дёҺC-Brй”®дёӯзҡ„з”өеӯҗеҜ№дёҖиө·зҰ»ејҖпјҢжәҙеҢ–зү©Br-з§°дёәзҰ»еҺ»еҹәеӣўгҖӮзҰ»еҺ»еҹәеӣў (LG) йҡҸй”®еҗҲз”өеӯҗеҜ№зҰ»ејҖпјҢ并еңЁеҸ–д»ЈеҸҚеә”дёӯиў«дәІж ёиҜ•еүӮеҸ–д»ЈгҖӮеҰӮжһңжІЎжңүйҖӮеҪ“зҡ„зҰ»еҺ»еҹәеӣўпјҢеҚідҪҝдәІж ёиҜ•еүӮиў«дәІз”өеӯҗиҜ•еүӮеҗёеј•пјҢеҸ–д»ЈеҸҚеә”д»Қз„¶ж— жі•иҝӣиЎҢгҖӮзҰ»еҺ»еҹәеӣўеҸҜд»ҘеёҰиҙҹз”өжҲ–дёӯжҖ§пјҢжҲ‘们е°ҶеңЁзЁҚеҗҺзҡ„иҜҰз»Ҷи®Ёи®әдёӯзңӢеҲ°гҖӮ
еә”з”ЁиҝҷдёүдёӘе…ій”®жңҜиҜӯпјҢдёҠиҝ°еҸ–д»ЈеҸҚеә”еҸҜд»ҘжҰӮжӢ¬дёәпјҡдәІж ёиҜ•еүӮеҸ–д»Јеә•зү©дёӯзҡ„зҰ»еҺ»еҹәеӣўпјҢеӣ жӯӨиҝҷз§ҚеҸҚеә”з§°дёәдәІж ёеҸ–д»ЈеҸҚеә”гҖӮеӣ жӯӨпјҢдәІж ёеҸ–д»ЈеҸҚеә”еҸҜд»Ҙз”ЁжӣҙдёҖиҲ¬зҡ„ж–№ејҸиЎЁзӨәпјҡ

жіЁж„ҸпјҡдәІж ёиҜ•еүӮе’ҢзҰ»еҺ»еҹәеӣўдёҚдёҖе®ҡеёҰиҙҹз”өпјҢеӣ дёәе®ғ们еҸҜд»ҘжҳҜдёӯжҖ§зҡ„пјҢеҰӮеүҚжүҖиҝ°гҖӮ
дәІж ёеҸ–д»ЈеҸҚеә”еҠЁеҠӣеӯҰ
еҠЁеҠӣеӯҰжҳҜеҜ№еҢ–еӯҰеҸҚеә”йҖҹзҺҮжҲ–еҸҚеә”еҸ‘з”ҹйҖҹеәҰзҡ„з ”з©¶гҖӮеҸҚеә”йҖҹзҺҮж•°жҚ®жңүеҠ©дәҺйҳҗжҳҺеҸҚеә”жңәеҲ¶жҲ–йҖҗжӯҘз”өеӯҗиҪ¬з§»иҝҮзЁӢгҖӮдәІж ёеҸ–д»ЈеҸҚеә”зҡ„еҠЁеҠӣеӯҰз ”з©¶иЎЁжҳҺпјҢжӯӨзұ»еҸҚеә”жңүдёӨз§ҚдёҚеҗҢзҡ„йҖҹзҺҮе®ҡеҫӢиЎЁиҫҫејҸгҖӮеҜ№дәҺдёӢйқўзҡ„дёӨдёӘеҸҚеә”пјҢеҸҚеә” 1 жҳҜдәҢйҳ¶еҸҚеә”пјҢиҖҢеҸҚеә” 2 жҳҜдёҖйҳ¶еҸҚеә”гҖӮеҠЁеҠӣеӯҰйҖҹзҺҮдёҚеҗҢзҡ„е”ҜдёҖеҺҹеӣ жҳҜеҸҚеә”з»ҸеҺҶдёҚеҗҢзҡ„еҸҚеә”жңәеҲ¶гҖӮ
еӣҫ7.1b еҸҚеә”1пјҡдәҢзә§еҸҚеә”
еҸҚеә”1жҳҜжҲ‘们已з»ҸзҶҹжӮүзҡ„еҸ–д»ЈеҸҚеә”гҖӮиҝҷжҳҜдәҢзә§еҸҚеә”гҖӮиҝҷж„Ҹе‘ізқҖеҸҚеә”йҖҹзҺҮеҸ–еҶідәҺеә•зү© CH 3 Br е’ҢдәІж ёиҜ•еүӮ OH вҖ“ зҡ„жө“еәҰгҖӮеҰӮжһңCH 3 Br зҡ„жө“еәҰеҠ еҖҚпјҢеҸҚеә”йҖҹзҺҮеҠ еҖҚпјҢеҰӮжһңOH вҖ“ зҡ„жө“еәҰеҠ еҖҚпјҢеҸҚеә”йҖҹзҺҮд№ҹеҠ еҖҚгҖӮеҪ“CH 3 Brе’ҢOH вҖ“ зҡ„жө“еәҰйғҪеҠ еҖҚж—¶пјҢеҸҚеә”йҖҹзҺҮеўһеҠ еӣӣеҖҚгҖӮ
еӣҫ 7.1c еҸҚеә” 2пјҡдёҖзә§еҸҚеә”
еҸҚеә”2жҳҜеҸҰдёҖдёӘеҸ–д»ЈеҸҚеә”зҡ„дҫӢеӯҗгҖӮиҝҷйҮҢзҡ„еә•зү©жҳҜеҸ”жәҙеҢ–зү©пјҢдәІж ёиҜ•еүӮжҳҜдёӯжҖ§ж°ҙеҲҶеӯҗгҖӮдҪңдёәдёҖзә§еҸҚеә”пјҢеҸҚеә”йҖҹзҺҮд»…еҸ–еҶідәҺеә•зү©(CH 3 ) 3 CBr зҡ„жө“еәҰпјҢдёҺдәІж ёиҜ•еүӮж— е…ігҖӮ
дёӨзұ»еҸҚеә”еҜ№еә”дёӨзұ»еҸҚеә”жңәзҗҶпјҡ
дәҢзә§еҸҚеә”з»ҸеҺҶеҸҢеҲҶеӯҗеҸҚеә”жңәеҲ¶пјҢз§°дёәS N 2 еҸҚеә”пјҢж„ҸжҖқжҳҜеҸ–д»ЈгҖҒдәІж ёе’ҢеҸҢеҲҶеӯҗгҖӮ
дёҖзә§еҸҚеә”з»ҸеҺҶеҚ•еҲҶеӯҗеҸҚеә”жңәеҲ¶пјҢз§°дёәS N 1 еҸҚеә”пјҢж„ҸжҖқжҳҜеҸ–д»ЈгҖҒдәІж ёе’ҢеҚ•еҲҶеӯҗгҖӮ
жҲ‘们е°ҶеҲҶеҲ«еҜ№S N 2 е’ҢS N 1 жңәеҲ¶иҝӣиЎҢиҜҰз»Ҷи®Ёи®әпјҢ然еҗҺжҜ”иҫғе®ғ们д№Ӣй—ҙзҡ„ејӮеҗҢгҖӮ
7.2 SN2еҸҚеә”жңәзҗҶгҖҒиғҪйҮҸеӣҫе’Ңз«ӢдҪ“еҢ–еӯҰ
S N 2 еҸҚеә”жңәзҗҶ
жҲ‘们д»Қ然д»Ҙ CH 3 Br е’Ң OH вҖ“ д№Ӣй—ҙзҡ„еҸҚеә”дҪңдёә S N 2 жңәзҗҶзҡ„дҫӢеӯҗгҖӮ
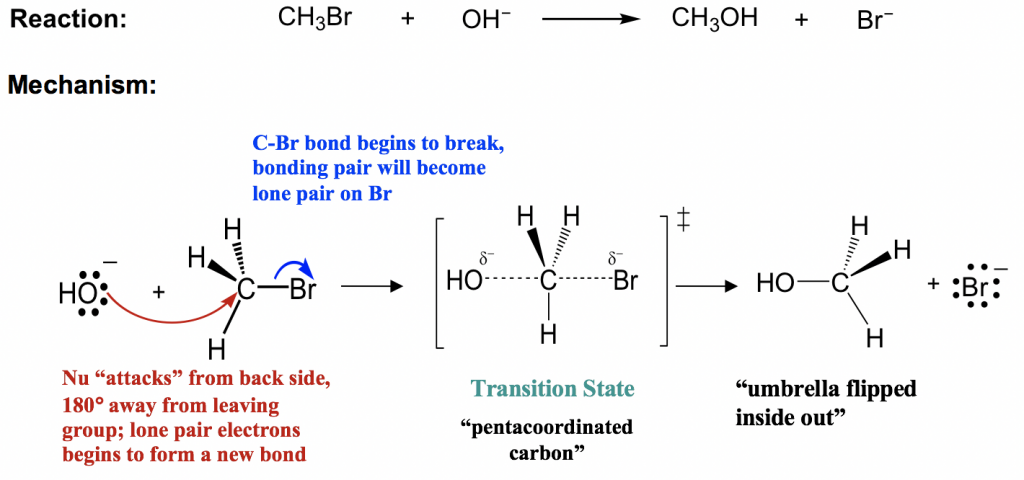
S N 2 жңәеҲ¶ж¶үеҸҠеҗҢж—¶еҸ‘з”ҹзҡ„дёӨдёӘз”өеӯҗеҜ№иҪ¬з§»пјӣдәІж ёиҜ•еүӮж”»еҮ»пјҲзәўиүІз®ӯеӨҙпјү并зҰ»ејҖеҹәеӣўзҰ»ејҖпјҲи“қиүІз®ӯеӨҙпјүгҖӮдәІж ёиҜ•еүӮ OH вҖ“ д»ҺиғҢйқўжҺҘиҝ‘дәІз”өеӯҗзўіпјҢиҜҘиғҢйқўдёҺзҰ»еҺ»еҹәеӣў Br зҰ»ејҖзҡ„ж–№еҗ‘зӣёеҸҚгҖӮйҡҸзқҖдәІж ёиҜ•еүӮ OH вҖ“ и¶ҠжқҘи¶Ҡиҝ‘пјҢBr д№ҹејҖе§ӢзҰ»ејҖгҖӮж–°зҡ„C-OHй”®зҡ„еҪўжҲҗе’Ңж—§зҡ„C-Brй”®зҡ„ж–ӯиЈӮеҗҢж—¶еҸ‘з”ҹгҖӮеңЁеҫҲзҹӯзҡ„зһ¬жҖҒзһ¬й—ҙпјҢзўіеҺҹеӯҗеҗҢж—¶дёҺOHе’ҢBrйғЁеҲҶиҝһжҺҘпјҢиҝҷз»ҷеҮәдәҶж•ҙдёӘиҝҮзЁӢзҡ„жңҖй«ҳиғҪзә§зҠ¶жҖҒпјҢз§°дёәиҝҮжёЎжҖҒгҖӮеңЁS N 2 еҸҚеә”зҡ„иҝҮжёЎжҖҒдёӯпјҢзўіе‘Ёеӣҙжңүдә”дёӘеҹәеӣўпјҢзўіеҸҜд»Ҙз§°дёәвҖңдә”й…ҚдҪҚвҖқгҖӮйҡҸзқҖ OH вҖ“ 继з»ӯйқ иҝ‘зўіпјҢBr дёҺжҲҗй”®з”өеӯҗеҜ№дёҖиө·иҝңзҰ»зўігҖӮжңҖз»ҲпјҢж–°й”®е®Ңе…ЁеҪўжҲҗпјҢж—§й”®е®Ңе…Ёж–ӯиЈӮпјҢеҫ—еҲ°дә§зү©CH 3 OHгҖӮ
еңЁиҜҘжңәеҲ¶дёӯпјҢеҸҚеә”еңЁж¶үеҸҠдәІж ёиҜ•еүӮе’Ңеә•зү©зҡ„дёҖжӯҘдёӯиҝӣиЎҢпјҢеӣ жӯӨеўһеҠ д»»дёҖиҖ…зҡ„жө“еәҰйғҪдјҡеўһеҠ зў°ж’һзҡ„еҸҜиғҪжҖ§пјҢиҝҷи§ЈйҮҠдәҶ S N зҡ„дәҢзә§еҠЁеҠӣеӯҰ2еҸҚеә”гҖӮз”ұдәҺдәІж ёиҜ•еүӮзҡ„ж”»еҮ»е’ҢзҰ»еҺ»еҹәеӣўзҡ„зҰ»ејҖеҗҢж—¶еҸ‘з”ҹпјҢS N 2 д№ҹиў«з§°дёәеҚҸеҗҢжңәеҲ¶пјҢеӣ дёәеҚҸеҗҢж„Ҹе‘ізқҖеҗҢж—¶еҸ‘з”ҹгҖӮ
з»ҳеҲ¶ S N 2 жңәжһ„зҡ„жіЁж„ҸдәӢйЎ№пјҡ
з»ҳеҲ¶ S N 2 жңәжһ„ж—¶еҝ…йЎ»жҳҫзӨәдёӨдёӘз®ӯеӨҙгҖӮдёӨиҖ…йғҪеҝ…йЎ»д»ҘжӯЈзЎ®зҡ„ж–№еҗ‘жҳҫзӨәпјҡдәІж ёиҜ•еүӮд»ҺдёҺзҰ»еҺ»еҹәеӣўеҸ¶еӯҗзӣёеҸҚзҡ„ж–№еҗ‘иҝӣиЎҢж”»еҮ»пјҢеҚіиғҢйқўж”»еҮ»гҖӮ
иҝҮжёЎзҠ¶жҖҒжҳҜеҸҜйҖүзҡ„пјҲеҸ–еҶідәҺй—®йўҳзҡ„иҰҒжұӮпјүгҖӮ然иҖҢпјҢйҮҚиҰҒзҡ„жҳҜиҰҒдәҶи§ЈеҸҚеә”иҝҮзЁӢеңЁдә§з”ҹдә§е“Ғд№ӢеүҚдјҡз»ҸеҺҶиҝҮжёЎжҖҒгҖӮ
иҜ·жіЁж„ҸпјҢиҜҘдә§е“ҒдёӯпјҢзўіе‘Ёеӣҙзҡ„дёүдёӘж°ўзҡ„дҪҚзҪ®йғҪиў«жҺЁеҲ°дәҶеҸҰдёҖдҫ§пјҢзўізҡ„ж•ҙдҪ“жһ„еһӢеҸ‘з”ҹдәҶеҖ’зҪ®пјҢе°ұеғҸжҡҙйЈҺйӣЁдёӯзҝ»иҪ¬зҡ„йӣЁдјһдёҖж ·гҖӮеҜ№дәҺиҜҘеҸҚеә”дёӯзҡ„дә§зү©пјҲCH 3 OHпјүпјүжқҘиҜҙдјјд№Һ并дёҚйҮҚиҰҒпјҢдҪҶеҰӮжһңзўіжҳҜжүӢжҖ§дёӯеҝғпјҢеҲҷзЎ®е®һдјҡдә§з”ҹеҪұе“ҚгҖӮ
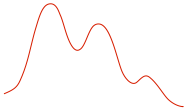
S N 2 жңәеҲ¶зҡ„иғҪйҮҸеӣҫ
дёҠиҝ°еҸҚеә”зҡ„иғҪйҮҸеҸҳеҢ–еҸҜд»Ҙз”Ёеӣҫ7.1жүҖзӨәзҡ„иғҪйҮҸеӣҫиЎЁзӨәгҖӮ S N 2 жҳҜеҚ•жӯҘеҸҚеә”пјҢеӣ жӯӨеӣҫдёӯеҸӘжңүдёҖжқЎжӣІзәҝгҖӮдә§зү© CH 3 OH е’Ң Br вҖ“ зҡ„иғҪйҮҸдҪҺдәҺеҸҚеә”зү© CH 3 Br е’Ң OH вҖ“ зҡ„иғҪйҮҸпјҢиҝҷиЎЁжҳҺж•ҙдёӘеҸҚеә”жҳҜж”ҫзғӯзҡ„пјҢдә§зү©жӣҙзЁіе®ҡгҖӮ
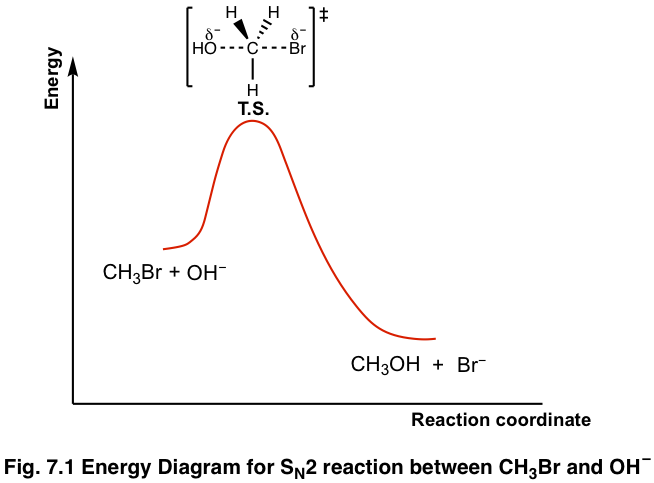
жӣІзәҝзҡ„йЎ¶йғЁеҜ№еә”дәҺиҝҮжёЎжҖҒпјҢе®ғжҳҜеҸҚеә”дёӯж¶үеҸҠзҡ„жңҖй«ҳиғҪйҮҸз»“жһ„гҖӮиҝҮжёЎжҖҒжҖ»жҳҜж¶үеҸҠйғЁеҲҶй”®гҖҒйғЁеҲҶеҪўжҲҗй”®е’ҢйғЁеҲҶж–ӯиЈӮй”®пјҢеӣ жӯӨе®ғйқһеёёдёҚзЁіе®ҡпјҢжІЎжңүжҳҺжҳҫзҡ„еҜҝе‘ҪгҖӮеӣ жӯӨпјҢиҝҮжёЎжҖҒж°ёиҝңдёҚеҸҜиғҪиў«еӯӨз«ӢгҖӮиҝҮжёЎжҖҒзҡ„з»“жһ„йҖҡеёёжҳҫзӨәеңЁеёҰжңүеҸҢеҢ•йҰ–дёҠж Үзҡ„ж–№жӢ¬еҸ·дёӯгҖӮ
еҚӨд»Јзғ·з»“жһ„еҜ№S N 2 еҸҚеә”йҖҹзҺҮзҡ„еҪұе“Қ
еҲ°зӣ®еүҚдёәжӯўпјҢеҜ№дәҺS N 2 жңәзҗҶзҡ„и®Ёи®әпјҢжҲ‘们йҮҚзӮ№е…іжіЁз”ІеҹәжәҙCH 3 Br зҡ„еҸҚеә”гҖӮе…¶д»–зғ·еҹәеҚӨеҢ–зү©д№ҹеҸҜд»ҘеҸ‘з”ҹS N 2 еҸҚеә”гҖӮеҜ№S N 2 еҸҚеә”йҖҹзҺҮзҡ„з ”з©¶иЎЁжҳҺпјҢеҚӨд»Јзғ·дёӯдәІз”өеӯҗзўізҡ„з»“жһ„зұ»еҲ«еҜ№еҸҚеә”йҖҹзҺҮеҪұе“ҚеҫҲеӨ§гҖӮ
зғ·еҹәеҚӨеҢ–зү©зұ»еһӢ | зғ·еҹәеҚӨеҢ–зү© з»“жһ„ | зӣёеҜ№зҺҮ |
з”Іеҹә | CH3X | 30 |
е°ҸеӯҰ (1В°) | RCH2вҖ“X | 1 |
дёӯеӯҰ (2В°) |
| 0.03 |
第дёүеұҠ (3В°) пјҲж— SN2еҸҚеә”пјү |
| еҫ®дёҚи¶ійҒ“ |
иЎЁ 7.1 SN2 еҜ№дёҚеҗҢзұ»еһӢеҚӨд»Јзғ·зҡ„зӣёеҜ№еҸҚеә”йҖҹзҺҮ
еҰӮиЎЁ 7.1 жүҖзӨәпјҢз”ІеҹәеҚӨеҢ–зү©е’ҢдјҜеҚӨеҢ–зү©жҳҜйҖҹзҺҮжңҖй«ҳзҡ„еә•зү©пјҢд»ІеҚӨеҢ–зү©зҡ„йҖҹзҺҮдёӢйҷҚеҫҲеӨҡпјҢиҖҢеҸ”еҚӨеҢ–зү©ж №жң¬дёҚеҸ‘з”ҹ S N 2 еҸҚеә”пјҢеӣ дёәйҖҹзҺҮеӨӘдҪҺдәҶпјҢдёҚе®һз”ЁгҖӮ
еӣ жӯӨпјҢеҚӨд»Јзғ·еҜ№ S N 2 еҸҚеә”зҡ„зӣёеҜ№еҸҚеә”жҖ§еҸҜжҖ»з»“дёәпјҡ

дёәд»Җд№Ҳи¶ӢеҠҝдјҡжҳҜиҝҷж ·е‘ўпјҹиҝҷеҸҜд»ҘйҖҡиҝҮS N 2 еҸҚеә”зҡ„жңәзҗҶжқҘи§ЈйҮҠгҖӮе®һйҷ…дёҠпјҢиҝҷжҳҜ科еӯҰ家用жқҘжҸҗеҮәиҜҘжңәеҲ¶зҡ„е®һйӘҢиҜҒжҚ®д№ӢдёҖгҖӮ S N 2 жңәеҲ¶зҡ„дёҖдёӘе…ій”®зү№еҫҒжҳҜдәІж ёиҜ•еүӮд»ҺиғҢйқўиҝӣиЎҢж”»еҮ»гҖӮеҪ“дәІж ёиҜ•еүӮжҺҘиҝ‘зўіж—¶пјҢжңҖе®№жҳ“жҺҘиҝ‘з”ІеҹәзўіпјҢеӣ дёәзўідёҠиҝһжҺҘзҡ„ж°ўеҺҹеӯҗе°әеҜёеҫҲе°ҸгҖӮйҡҸзқҖиҝһжҺҘеңЁзўідёҠзҡ„еҹәеӣўзҡ„е°әеҜёеҸҳеӨ§пјҢжҺҘиҝ‘зўіеҸҳеҫ—жӣҙеҠ еӣ°йҡҫпјҢ并且еҜ№дәҺиҝһжҺҘжңүдёүдёӘеӨ§зғ·еҹәзҡ„еҸ”зўіжқҘиҜҙпјҢиҝҷз§ҚжҺҘиҝ‘иў«е®Ңе…Ёйҳ»жӯўгҖӮеӣ жӯӨпјҢеҸҚеә”жҖ§е·®ејӮжң¬иҙЁдёҠжҳҜз”ұз©әй—ҙж•Ҳеә”еј•иө·зҡ„гҖӮдҪҚйҳ»ж•Ҳеә”еҹәдәҺеҹәеӣўзҡ„дҪҚйҳ»еӨ§е°ҸжҲ–дҪ“з§ҜгҖӮз”ұдәҺдәІз”өзўідёҠеӨ§еҹәеӣўзҡ„з©әй—ҙдҪҚйҳ»пјҢдәІж ёиҜ•еүӮдёҚжҳ“иҝӣиЎҢиғҢйқўж”»еҮ»пјҢеӣ жӯӨдәҢзә§пјҲ2В°пјүе’Ңдёүзә§пјҲ3В°пјүзҡ„S N 2 еҸҚеә”йҖҹзҺҮпјүеә•зү©жҖҘеү§еҮҸе°‘гҖӮ 3В°еә•зү©дёҚз¬ҰеҗҲS N 2 еҸҚеә”жңәзҗҶпјҢеӣ дёәеҸҚеә”йҖҹзҺҮеӨӘж…ўгҖӮ
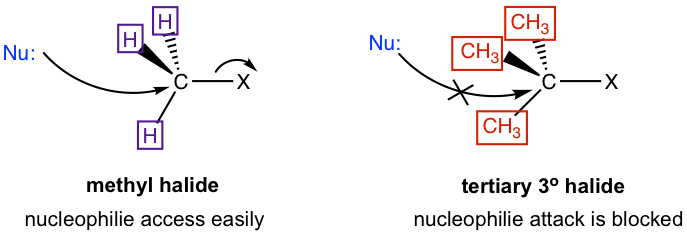
S N 2 еҸҚеә”зҡ„з«ӢдҪ“еҢ–еӯҰ
S N 2 еҸҚеә”жңәзҗҶзҡ„еҸҰдёҖдёӘзү№зӮ№жҳҜпјҢдёҺеҸҚеә”зү©зӣёжҜ”пјҢдә§зү©дёӯзўізҡ„ж•ҙдҪ“жһ„еһӢжҳҜйў еҖ’зҡ„пјҢе°ұеғҸдёҖжҠҠзҝ»иҝҮжқҘзҡ„йӣЁдјһгҖӮиҝҷз§Қжһ„еһӢзҡ„еҸҚиҪ¬з§°дёә Walden еҸҚиҪ¬гҖӮи®©жҲ‘们зңӢзңӢиҝҷз§ҚеҖ’иҪ¬зҡ„з«ӢдҪ“еҢ–еӯҰеҗҺжһңжҳҜд»Җд№ҲгҖӮ

д»Һ (R)-2-жәҙдёҒзғ·ејҖе§ӢгҖӮ S N 2 еҸҚеә”д»…дә§з”ҹ2-дёҒйҶҮдә§зү©зҡ„дёҖз§ҚеҜ№жҳ дҪ“пјҢ并且з”ұдәҺжһ„еһӢеҸҚиҪ¬пјҢеҸҜд»Ҙйў„жөӢдә§зү©зҡ„жһ„еһӢеә”иҜҘжҳҜSгҖӮ
жіЁпјҡеҸҚиҪ¬жҳҜжҢҮз»„зҡ„жҺ’еҲ—йў еҖ’пјҢдёҚеҝ…иҰҒжҳҜжҢҮз»қеҜ№жһ„еһӢгҖҒR/S йў еҖ’гҖӮдёҺжү№йҮҸжғ…еҶөдёӢзҡ„еҸҚеә”зү©зӣёжҜ”пјҢиҜҘдә§е“ҒзЎ®е®һе…·жңүеҖ’зҪ®зҡ„ R/S й…ҚзҪ®пјҢдҪҶдёҚиғҪдҝқиҜҒгҖӮеҝ…йЎ»ж №жҚ®дә§е“Ғзҡ„е®һйҷ…й…ҚзҪ®жқҘзЎ®е®ҡгҖӮ
7.3 еҪұе“ҚSN2еҸҚеә”зҡ„е…¶д»–еӣ зҙ
зҰ»ејҖйӣҶеӣў
еҪ“еҚӨд»Јзғ·еҸ‘з”ҹдәІж ёеҸ–д»ЈеҸҚеә”ж—¶пјҢеҚӨзҙ жҳҜзҰ»еҺ»еҹәеӣўгҖӮдёҚд»…еҚӨзҙ еҸҜд»ҘдҪңдёәзҰ»еҺ»еҹәеӣўпјҢе…¶д»–еҗҲйҖӮзҡ„еҹәеӣўд№ҹеҸҜд»ҘдҪңдёәзҰ»еҺ»еҹәеӣўгҖӮдёҖиҲ¬жқҘиҜҙпјҢдәІж ёеҸ–д»ЈеҸҚеә”йңҖиҰҒиүҜеҘҪзҡ„зҰ»еҺ»еҹәеӣўгҖӮеҰӮдҪ•еҲӨж–ӯзҰ»еҺ»еҹәеӣўзҡ„еҘҪеқҸпјҹеҪ“зҰ»еҺ»еҹәеӣўзҰ»ејҖж—¶пјҢе®ғдјҡеёҰиө°ж–ӯиЈӮй”®дёӯзҡ„з”өеӯҗеҜ№гҖӮжүҖд»ҘпјҢеҘҪзҡ„зҰ»еҺ»еҹәеӣўеә”иҜҘжҳҜиғҪеӨҹеҫҲеҘҪең°е®№зәіз”өеӯҗеҜ№зҡ„зҰ»еҺ»еҹәеӣўпјҢжҲ–иҖ…еҸҜд»ҘиҜҙпјҢеҘҪзҡ„зҰ»еҺ»еҹәеӣўеә”иҜҘдёҺз”өеӯҗеҜ№дҝқжҢҒзЁіе®ҡгҖӮ
е…·жңүз”өеӯҗеҜ№зҡ„еҹәеӣўзҡ„зЁіе®ҡжҖ§дёҺеҹәеӣўзҡ„зўұжҖ§жңүе…іпјҢеӣ дёәзўұжҖ§жҳҜжҢҮзү©з§Қе…ұдә«е…¶з”өеӯҗеҜ№зҡ„иғҪеҠӣгҖӮеӣ жӯӨпјҢејәзўұе…·жңүиҫғй«ҳзҡ„е…ұдә«з”өеӯҗеҜ№еҸҚеә”жҖ§пјҢеӣ жӯӨдёҚзЁіе®ҡпјҢдёҚиғҪжҲҗдёәиүҜеҘҪзҡ„зҰ»еҺ»еҹәеӣўгҖӮеҸҰдёҖж–№йқўпјҢе…ұдә«з”өеӯҗеҜ№еҖҫеҗ‘иҫғдҪҺзҡ„ејұзўұеҹәжҳҜжӣҙзЁіе®ҡзҡ„зўұеҹәпјҢеӣ жӯӨжҳҜиүҜеҘҪзҡ„зҰ»еҺ»еҹәеӣўгҖӮжүҖд»ҘпјҢжҖ»зҡ„и¶ӢеҠҝжҳҜпјҡ
еҹәеӣўзҡ„зўұжҖ§и¶ҠејұпјҢзҰ»еҺ»еҹәеӣўи¶ҠеҘҪгҖӮ
жҲ‘们еҜ№й…ёзўұдё»йўҳзҡ„дәҶи§ЈеҜ№дәҺжҜ”иҫғдёҚеҗҢзҰ»еҺ»еҹәеӣўд№Ӣй—ҙзҡ„ејәеәҰйқһеёёжңүеё®еҠ©гҖӮ
еҜ№дәҺеҚӨд»Јзғ·пјҢдҪңдёәзҰ»еҺ»еҹәеӣўзҡ„зӣёеҜ№еҸҚеә”жҖ§дёәпјҡ
пјҲжңҖдҪізҰ»еҺ»еҹәеӣўпјү I вҖ“ > Br вҖ“ > Cl вҖ“ > F вҖ“ пјҲжңҖејұзҰ»еҺ»еҹәеӣўпјү
иҜҘйЎәеәҸдёҺеҚӨеҢ–зү©йҳҙзҰ»еӯҗзҡ„зӣёеҜ№зўұеәҰзӣёеҢ№й…ҚгҖӮ I вҖ“ жҳҜжңҖејұзҡ„зўұеҹәпјҢд№ҹжҳҜжңҖеҘҪзҡ„зҰ»еҺ»еҹәеӣўгҖӮ
йҷӨдәҶеҚӨеҢ–зү©д№ӢеӨ–пјҢе…¶д»–еҹәеӣўд№ҹеҸҜд»ҘжҳҜзҰ»еҺ»еҹәеӣўгҖӮеңЁй…ёзўұз« иҠӮдёӯпјҢжҲ‘们еӯҰд№ дәҶдёҖдәӣејәжңүжңәй…ёзҡ„дҫӢеӯҗпјҢдҫӢеҰӮпјҢз”ІиӢҜзЈәй…ёпјҢTsOHзӯүгҖӮз”ұдәҺејәй…ёзҡ„е…ұиҪӯзўұжҳҜйқһеёёејұзҡ„зўұпјҢеӣ жӯӨиҝҷдәӣй…ёзҡ„е…ұиҪӯзўұжҳҜдёҚй”ҷзҡ„йҖүжӢ©д№ҹйҖӮз”ЁдәҺзҰ»ејҖеӣўдҪ“гҖӮзӨәдҫӢеҢ…жӢ¬пјҲзҰ»еҺ»еҹәеӣўд»Ҙи“қиүІзӘҒеҮәжҳҫзӨәпјүпјҡ
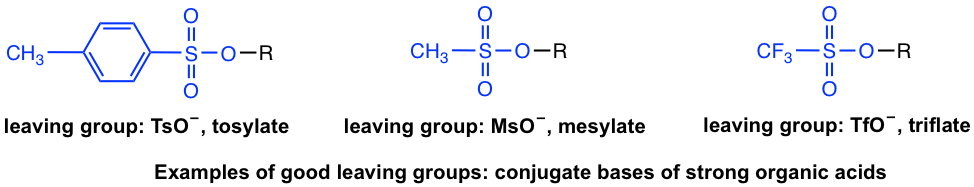
еӣҫ 7.3a иүҜеҘҪзҰ»еҺ»еҹәеӣўзҡ„зӨәдҫӢпјҡејәжңүжңәй…ёзҡ„е…ұиҪӯзўұ
еӣ жӯӨпјҢиҜёеҰӮ OH вҖ“ гҖҒ RO вҖ“ гҖҒ NH 2 вҖ“ е’Ң R вҖ“ зӯүејәзўұйқһеёёзҰ»еҺ»еҹәеӣўиҫғе·®пјҢдёҚиғҪиҝӣиЎҢдәІж ёеҸ–д»ЈеҸҚеә”гҖӮ然иҖҢпјҢеҜ№дәҺ OH вҖ“ жҲ– RO вҖ“ жқҘиҜҙпјҢеңЁиҙЁеӯҗеҢ–еҗҺпјҢе®ғ们еҸҜд»ҘиҪ¬еҢ–дёәдёӯжҖ§ H2O жҲ– ROH еҲҶеӯҗпјҢе®ғ们жҳҜйҖӮеҗҲеҸ–д»Јзҡ„зҰ»еҺ»еҹәеӣўгҖӮиҜҘдё»йўҳе°ҶеңЁ 7.6 иҠӮдёӯд»Ӣз»ҚгҖӮ
жіЁпјҡйҡҸзқҖзҰ»еҺ»еҹәеӣўиҢғеӣҙзҡ„жү©еӨ§пјҢеҸ–д»ЈеҸҚеә”дёҚд»…йҷҗдәҺеҚӨд»Јзғ·гҖӮд»»дҪ•е…·жңүиүҜеҘҪзҰ»еҺ»еҹәеӣўзҡ„еҢ–еҗҲзү©йғҪеҸҜд»ҘеҸ‘з”ҹдәІж ёеҸ–д»ЈгҖӮ
дәІж ёиҜ•еүӮ
еҜ№дәҺS N 2 еҸҚеә”пјҢдәІж ёиҜ•еүӮжҳҜйҖҹзҺҮеҶіе®ҡеӣ зҙ д№ӢдёҖпјӣеӣ жӯӨпјҢејәдәІж ёиҜ•еүӮжңүеҠ©дәҺеҠ йҖҹS N 2 еҸҚеә”гҖӮ
дәІж ёиҜ•еүӮзҡ„зӣёеҜ№ејәеәҰз§°дёәдәІж ёжҖ§гҖӮдәІж ёиҜ•еүӮзҡ„дәІж ёжҖ§жҳҜж №жҚ®е…¶дёҺзӣёеҗҢеә•зү©зҡ„S N 2 еҸҚеә”зҡ„зӣёеҜ№йҖҹзҺҮжқҘжөӢйҮҸзҡ„гҖӮдёҖиҲ¬жқҘиҜҙпјҢдәІж ёи¶ӢеҠҝеҸ–еҶідәҺдәІж ёиҜ•еүӮзҡ„еҮ дёӘз»“жһ„зү№еҫҒгҖӮ
еёҰиҙҹз”өиҚ·зҡ„дәІж ёиҜ•еүӮжҖ»жҳҜжҜ”зӣёеә”зҡ„дёӯжҖ§дәІж ёиҜ•еүӮејәгҖӮдҫӢеҰӮпјҡOH вҖ“ > H 2 Oпјӣ RO вҖ“ > ROHгҖӮ
дәІж ёжҖ§йҡҸзқҖж—¶й—ҙзҡ„жҺЁз§»иҖҢйҷҚдҪҺгҖӮдҫӢеҰӮпјҡNH 3 > H 2 Oпјӣ RNH 2 > ROH
ж•ҙдёӘеҹәеӣўзҡ„дәІж ёжҖ§еўһеҠ гҖӮдҫӢеҰӮпјҡ
RSH > ROHпјӣ RS вҖ“ > RO вҖ“ ;
I вҖ“ > Br вҖ“ > Cl вҖ“ > F вҖ“ пјҲиҙЁеӯҗжә¶еүӮпјү
иҫғе°Ҹзҡ„еҹәеӣўжҜ”еӨ§зҡ„еҹәеӣўжҳҜжӣҙеҘҪзҡ„дәІж ёиҜ•еүӮгҖӮ
дҫӢеҰӮпјҢt-BuO вҖ“ 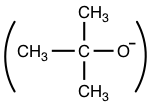
з”ұдәҺе…¶дҪ“з§ҜеәһеӨ§пјҢжҳҜдёҖз§Қйқһеёёе·®зҡ„дәІж ёиҜ•еүӮгҖӮ
дёәдәҶж–№дҫҝз ”з©¶пјҢзҺ°е°Ҷеёёз”Ёзҡ„ејәдәІж ёиҜ•еүӮе’ҢејұдәІж ёиҜ•еүӮеҲ—еҮәеҰӮдёӢпјҡ
ејәпјҲиүҜпјүдәІж ёиҜ•еүӮпјҡ OH вҖ“ гҖҒRO вҖ“ пјҲе°ҸйҶҮзӣҗпјүгҖҒRS вҖ“ пјҲзЎ«йҶҮзӣҗпјүгҖҒN 3 вҖ“ пјҲеҸ ж°®еҢ–зү©пјүгҖҒCN вҖ“ пјҲж°°еҢ–зү©пјүгҖҒCl вҖ“ гҖҒBr вҖ“ гҖҒI вҖ“ пјҲеҚӨеҢ–зү©пјү , RCO 2 вҖ“ пјҲзҫ§й…ёзӣҗпјүпјҢRNH 2 пјҲиғәпјү
ејұпјҲе·®пјүдәІж ёиҜ•еүӮпјҡROHгҖҒH 2 OгҖҒt-BuO вҖ“
з”ұдәҺдәІж ёиҜ•еүӮзҡ„з»“жһ„еҰӮжӯӨеӨҡж ·еҢ–пјҢS N 2 еҸҚеә”еҸҜз”ЁдәҺеҗҲжҲҗе…·жңүеӨҡз§Қе®ҳиғҪеӣўзҡ„еҢ–еҗҲзү©пјҢеҰӮдёӢжүҖзӨәгҖӮ
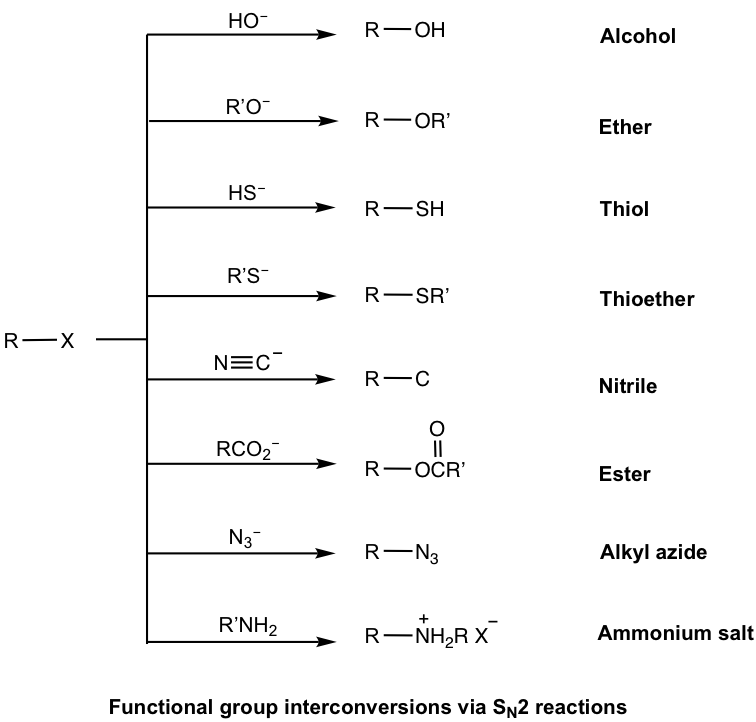
еӣҫ 7.3b йҖҡиҝҮ SN2 еҸҚеә”иҝӣиЎҢзҡ„е®ҳиғҪеӣўзӣёдә’иҪ¬еҢ–
дҫӢеӯҗ
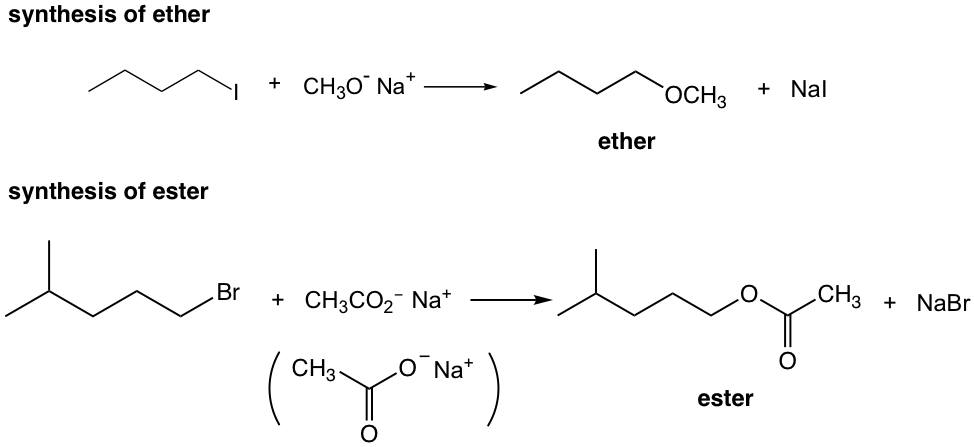
7.4 SN1еҸҚеә”жңәзҗҶгҖҒиғҪйҮҸеӣҫе’Ңз«ӢдҪ“еҢ–еӯҰ
S N 1 еҸҚеә”жңәзҗҶ
еҸ”дёҒеҹәжәҙе’Ңж°ҙд№Ӣй—ҙзҡ„еҸҚеә”йҖҡиҝҮ SN1 жңәзҗҶиҝӣиЎҢгҖӮдёҺS N 2 дёәеҚ•жӯҘеҸҚеә”дёҚеҗҢпјҢS N 1 еҸҚеә”ж¶үеҸҠеӨҡдёӘжӯҘйӘӨгҖӮеҸҚеә”пјҡ(CH 3 ) 3 CBr + H 2 O вҶ’ (CH 3 ) 3 COH +ж°ўжәҙй…ё
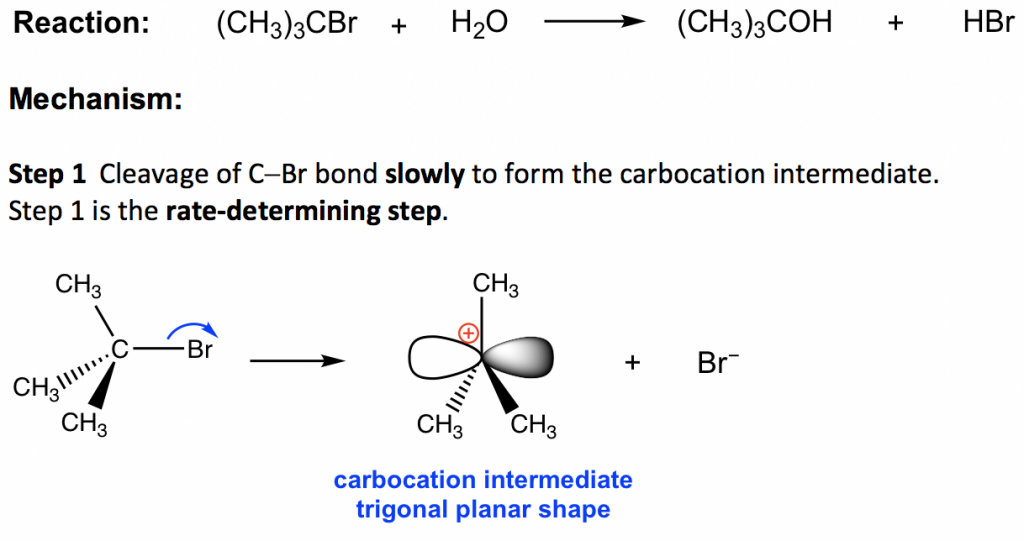
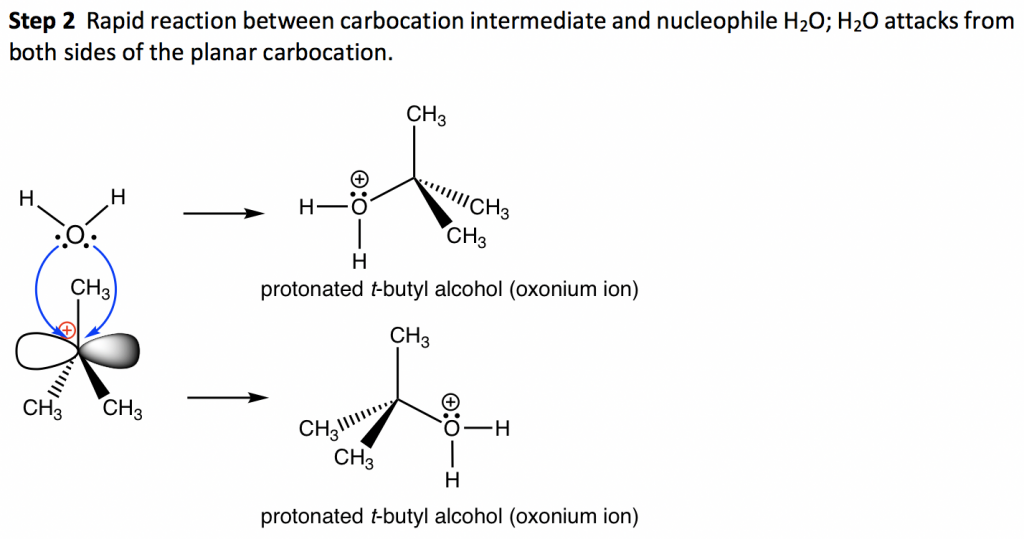
жӯҘйӘӨ1дёӯпјҢC-Brй”®ж–ӯиЈӮпјҢBrдёҺжҲҗй”®з”өеӯҗеҜ№и„ұзҰ»пјҢдә§з”ҹеҸ”зўіжӯЈзҰ»еӯҗе’ҢжәҙйҳҙзҰ»еӯҗBr вҖ“ гҖӮиҜҘжӯҘйӘӨд»…ж¶үеҸҠй«ҳеәҰеҗёзғӯзҡ„ж–ӯй”®иҝҮзЁӢпјҢ并且иҝҷжҳҜж•ҙдёӘжңәеҲ¶дёӯжңҖж…ўзҡ„жӯҘйӘӨгҖӮеңЁеӨҡжӯҘжңәеҲ¶дёӯпјҢжҖ»еҸҚеә”йҖҹзҺҮз”ұжңҖж…ўзҡ„жӯҘйӘӨеҶіе®ҡпјҢеӣ жӯӨиҝҷж ·зҡ„жӯҘйӘӨз§°дёәйҖҹзҺҮеҶіе®ҡжӯҘйӘӨгҖӮеңЁ SN1 еҸҚеә”дёӯпјҢжӯҘйӘӨ 1 жҳҜжңҖж…ўзҡ„жӯҘйӘӨпјҢеӣ жӯӨд№ҹжҳҜеҶіе®ҡйҖҹзҺҮзҡ„жӯҘйӘӨгҖӮйҖҹзҺҮеҶіе®ҡжӯҘйӘӨд»…ж¶үеҸҠзғ·еҹәеҚӨеҢ–зү©еә•зү©пјҢиҝҷе°ұжҳҜдёәд»Җд№Ҳж•ҙдҪ“йҖҹзҺҮе®ҡеҫӢжҳҜдёҖйҳ¶зҡ„пјҢеӣ дёәдәІж ёиҜ•еүӮдёҚеҸӮдёҺйҖҹзҺҮеҶіе®ҡжӯҘйӘӨгҖӮ
жӯҘйӘӨ 1 зҡ„дә§зү©зўіжӯЈзҰ»еӯҗе°ҶжҳҜдёӢдёҖжӯҘзҡ„еҸҚеә”зү©пјҢз§°дёә S N 1 еҸҚеә”зҡ„дёӯй—ҙдҪ“гҖӮдёӯй—ҙдҪ“жҳҜдёҖз§ҚдёҚзЁіе®ҡгҖҒй«ҳеҸҚеә”жҖ§зҡ„зү©иҙЁпјҢеҜҝе‘ҪеҫҲзҹӯгҖӮзўіжӯЈзҰ»еӯҗдёӯй—ҙдҪ“е‘Ҳдёүи§’еҪўе№ійқўеҪўзҠ¶пјҢз©ә2pиҪЁйҒ“жҳҜиҜҘе№ійқўзү№жңүзҡ„гҖӮдёӯеҝғзўідёәsp 2 жқӮеҢ–дё”е…·жңүдёҚе®Ңж•ҙзҡ„е…«дҪҚз»„пјҢеӣ жӯӨзўіжӯЈзҰ»еӯҗжҳҜй«ҳеҸҚеә”жҖ§дёӯй—ҙдҪ“пјҢд№ҹжҳҜдәІз”өеӯҗиҜ•еүӮгҖӮ
жӯҘйӘӨ2дёәдәІж ёж”»еҮ»жӯҘйӘӨпјҢдәІж ёдҪ“H 2 OеҲ©з”Ёе…¶еӯӨз”өеӯҗеҜ№дёҺзўіжӯЈзҰ»еӯҗдёӯй—ҙдҪ“еҸҚеә”пјҢз”ҹжҲҗиҙЁеӯҗеҢ–зҡ„еҸ”дёҒйҶҮпјҲж°§йҺ“зҰ»еӯҗпјүгҖӮз”ұдәҺзўіжӯЈзҰ»еӯҗдёӯй—ҙдҪ“зҡ„е№ійқўеҪўзҠ¶пјҢдәІж ёиҜ•еүӮд»Һе№ійқўдёӨдҫ§ж”»еҮ»зҡ„еҸҜиғҪжҖ§зӣёеҗҢпјҢеӣ жӯӨеҸҜиғҪдә§з”ҹзӣёеҗҢйҮҸзҡ„дә§зү©гҖӮеҜ№дәҺиҝҷз§ҚеҸҚеә”пјҢд»Һд»»дҪ•дёҖж–№ж”»еҮ»йғҪдјҡдә§з”ҹзӣёеҗҢзҡ„дә§зү©пјҲдёәдәҶиҜҙжҳҺжҰӮеҝөпјҢд»Қ然жҳҫзӨәдёӨиҖ…пјүпјӣ然иҖҢпјҢеҰӮжһңдәІз”өеӯҗзўіжҳҜжүӢжҖ§дёӯеҝғпјҢе®ғдјҡдә§з”ҹдёҚеҗҢзҡ„з«ӢдҪ“ејӮжһ„дҪ“гҖӮ
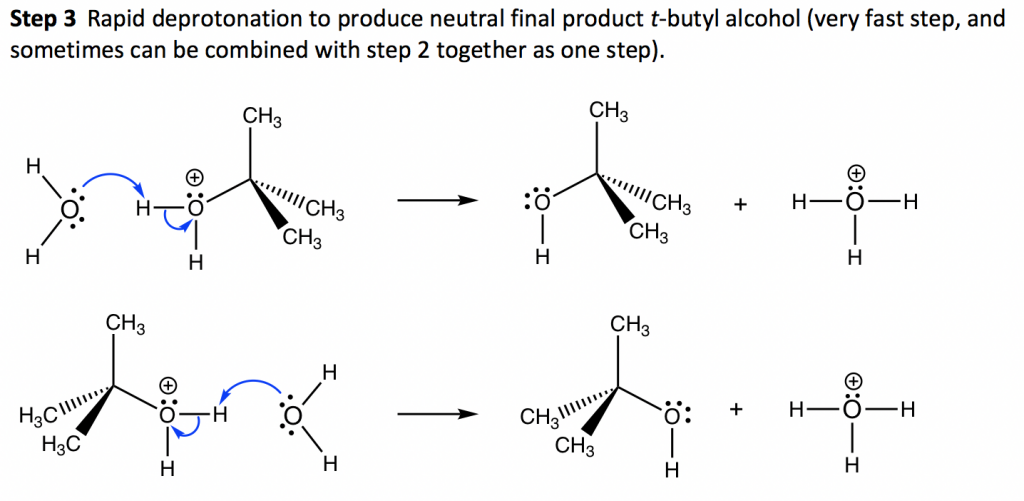
еңЁжӯҘйӘӨ3дёӯпјҢж°ҙеҲҶеӯҗдҪңдёәеёғжң—ж–ҜеҸ°еҫ·зўұжҺҘеҸ—жқҘиҮӘж°§йҺ“зҰ»еӯҗзҡ„иҙЁеӯҗпјҢ并дә§з”ҹжңҖз»Ҳзҡ„дёӯжҖ§дә§зү©еҸ”дёҒйҶҮгҖӮиҝҷдёҖеҺ»иҙЁеӯҗеҢ–жӯҘйӘӨйқһеёёеҝ«пјҢжңүж—¶еҸҜд»ҘдёҺжӯҘйӘӨ 2 з»“еҗҲеңЁдёҖиө·дҪңдёәдёҖдёӘжӯҘйӘӨпјҲеҚіжӯҘйӘӨ 3 еҸҜиғҪдёҚиў«и§ҶдёәеҚ•зӢ¬зҡ„жӯҘйӘӨпјүгҖӮ
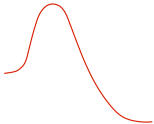
S N 1жңәзҗҶиғҪйҮҸеӣҫ
S N 1 жҳҜеӨҡжӯҘеҸҚеә”пјҢеӣ жӯӨеӣҫдёӯжңүеӨҡжқЎжӣІзәҝпјҢжҜҸдёҖжӯҘеҸҜд»Ҙз”ЁдёҖжқЎжӣІзәҝиЎЁзӨәгҖӮдёүдёӘжӯҘйӘӨдёӯпјҢжӯҘйӘӨ1зҡ„жҙ»еҢ–иғҪжңҖй«ҳпјӣеӣ жӯӨпјҢжӯҘйӘӨ 1 жҳҜжңҖж…ўзҡ„жӯҘйӘӨпјҢд№ҹжҳҜйҖҹзҺҮеҶіе®ҡжӯҘйӘӨгҖӮ
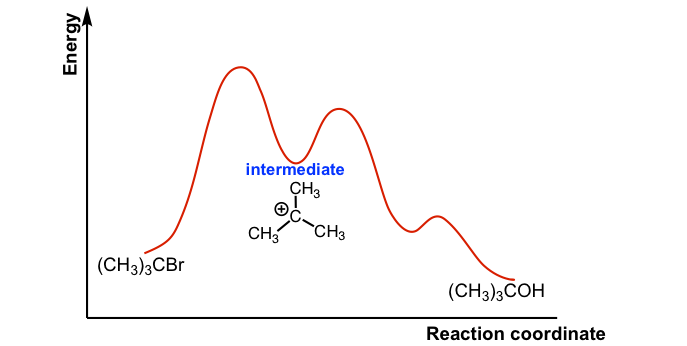
еӣҫ 7.4a (CH3)3CBr е’Ң H2O д№Ӣй—ҙ SN1 еҸҚеә”зҡ„иғҪйҮҸеӣҫ
еүҚдёӨжқЎжӣІзәҝд№Ӣй—ҙзҡ„иҝһжҺҘд»ЈиЎЁзўіжӯЈзҰ»еӯҗдёӯй—ҙдҪ“гҖӮйҖҡеёёпјҢдёӯй—ҙдҪ“жҳҜдёҖжӯҘеҸҚеә”зҡ„дә§зү©е’ҢдёӢдёҖжӯҘеҸҚеә”зҡ„еҸҚеә”зү©гҖӮдёҺиҝҮжёЎжҖҒпјҲеӨ„дәҺжӣІзәҝзҡ„еі°еҖјпјүзӣёжҜ”пјҢдёӯй—ҙдҪ“еӨ„дәҺзӣёеҜ№иҫғдҪҺзҡ„иғҪзә§пјҢдҪҶдёӯй—ҙдҪ“д№ҹе…·жңүй«ҳеҸҚеә”жҖ§е’ҢдёҚзЁіе®ҡгҖӮ
еә•зү©з»“жһ„еҜ№S N 1 еҸҚеә”йҖҹзҺҮзҡ„еҪұе“Қ
дёҚеҗҢеә•зү©еҜ№S N 1 еҸҚеә”зҡ„еҸҚеә”йҖҹзҺҮдёҚеҗҢпјҢеә•зү©еҜ№S N 1 еҸҚеә”зҡ„зӣёеҜ№еҸҚеә”жҙ»жҖ§еҸҜжҰӮжӢ¬дёәпјҡ

еӣҫ 7.4b еә•зү©еҜ№ SN1 еҸҚеә”зҡ„зӣёеҜ№еҸҚеә”жҖ§
е°ҶжӯӨи¶ӢеҠҝдёҺ S N 2 еҸҚеә”зҡ„и¶ӢеҠҝиҝӣиЎҢжҜ”иҫғпјҢжӮЁеҸҜиғҪдјҡж„ҸиҜҶеҲ°е®ғ们жҳҜзӣёеҸҚзҡ„гҖӮдёүзә§еә•зү©еҜ№ SN1 зҡ„еҸҚеә”жҖ§жңҖејәпјҢдҪҶе®ғж №жң¬дёҚеҸ‘з”ҹ S N 2пјӣеҲқзә§еә•зү©е’Ңз”Іеҹәеә•зү©еҜ№ S N 1 дёҚиө·еҸҚеә”пјҢдҪҶе®ғ们жҳҜ S N 2 зҡ„жңҖдҪіеә•зү©гҖӮиҝҷз§ҚжҜ”иҫғйқһеёёйҮҚиҰҒпјҢеҜ№дәҺжҲ‘们йҖүжӢ©еҗҲйҖӮзҡ„еҸҚеә”жқЎд»¶йқһеёёжңүз”ЁгҖӮжҲ‘们е°ҶеңЁдёӢдёҖиҠӮдёӯзңӢеҲ°дёҚеҗҢзҡ„еҹәжқҗгҖӮзҺ°еңЁпјҢжҲ‘们йңҖиҰҒдәҶи§Ј S N 1 и¶ӢеҠҝзҡ„жҺЁзҗҶгҖӮ
иҝҷжҳҜеӣ дёәзўійҳізҰ»еӯҗдёӯй—ҙдҪ“зҡ„зЁіе®ҡжҖ§гҖӮжңәзҗҶиЎЁжҳҺпјҢзўіжӯЈзҰ»еӯҗжҳҜеңЁйҷҗйҖҹжӯҘйӘӨдёӯеҪўжҲҗзҡ„пјҢеӣ жӯӨзўіжӯЈзҰ»еӯҗи¶ҠзЁіе®ҡпјҢи¶Ҡе®№жҳ“еҪўжҲҗпјҢи¶ҠжңүеҲ©дәҺйҷҗйҖҹжӯҘйӘӨпјҢеҠ еҝ«ж•ҙдёӘеҸҚеә”зҡ„йҖҹеәҰгҖӮеӣ жӯӨпјҢзўійҳізҰ»еӯҗдёӯй—ҙдҪ“и¶ҠзЁіе®ҡпјҢS N 1 еҸҚеә”зҡ„йҖҹзҺҮи¶Ҡеҝ«гҖӮ
дёӢйқўз»ҷеҮәдәҶзўіжӯЈзҰ»еӯҗзҡ„зӣёеҜ№зЁіе®ҡжҖ§пјҢе…¶дёӯеҸ”зўіжӯЈзҰ»еӯҗжңҖзЁіе®ҡпјҢз”ІеҹәзўіжӯЈзҰ»еӯҗжңҖдёҚзЁіе®ҡгҖӮ
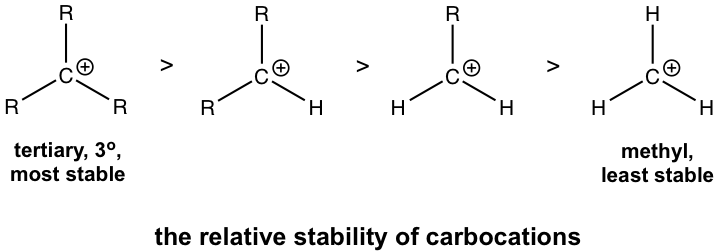
еӣҫ7.4c зўіжӯЈзҰ»еӯҗзҡ„зӣёеҜ№зЁіе®ҡжҖ§
зўійҳізҰ»еӯҗзҡ„зӣёеҜ№зЁіе®ҡжҖ§еҸҜд»ҘйҖҡиҝҮи¶…е…ұиҪӯж•Ҳеә”жқҘи§ЈйҮҠгҖӮи¶…е…ұиҪӯжҳҜеЎ«е……й”®еҗҲиҪЁйҒ“дёҺзӣёйӮ»жңӘеЎ«е……пјҲжҲ–еҚҠеЎ«е……пјүиҪЁйҒ“д№Ӣй—ҙзҡ„йғЁеҲҶиҪЁйҒ“йҮҚеҸ гҖӮзўіжӯЈзҰ»еӯҗжҳҜдёҖз§Қзјәз”өеӯҗзү©иҙЁпјҢе…·жңүдёҚе®Ңж•ҙзҡ„е…«дҪҚз»„е’Ңз©әзҡ„ 2p иҪЁйҒ“гҖӮеҰӮжһңжңүдёҖдёӘзғ·еҹәдёҺзўіжӯЈзҰ»еӯҗзӣёиҝһпјҢйӮЈд№ҲзўіжӯЈзҰ»еӯҗзўіж—Ғиҫ№е°ұжңүC-CжҲ–C-H Пғй”®пјҢеӣ жӯӨПғй”®зҡ„еЎ«е……иҪЁйҒ“е°ҶиғҪеӨҹдёҺз©әзҡ„2pиҪЁйҒ“йғЁеҲҶйҮҚеҸ гҖӮиҝҷе…Ғи®ёдёҺзўійҳізҰ»еӯҗе…ұдә«з”өеӯҗеҜҶеәҰпјҢд»ҺиҖҢзЁіе®ҡзўійҳізҰ»еӯҗгҖӮеҸӮдёҺзҡ„Rеҹәеӣўи¶ҠеӨҡпјҢи¶…е…ұиҪӯж•Ҳеә”и¶ҠејәгҖӮеӣ жӯӨпјҢдёүзә§пјҲ3В°пјүзўіжӯЈзҰ»еӯҗжҳҜжңҖзЁіе®ҡзҡ„гҖӮиҷҪ然甲еҹәзўіжӯЈзҰ»еӯҗCH 3 + дёӯжІЎжңүRеҹәеӣўпјҢдҪҶе®ғжҳҜжңҖдёҚзЁіе®ҡзҡ„гҖӮ
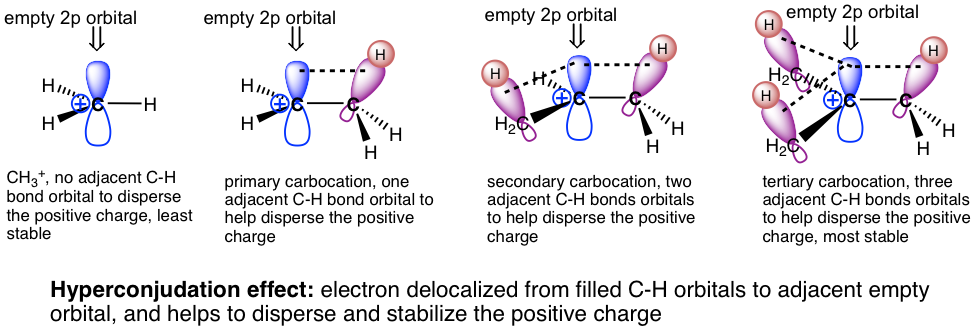
еӣҫ7.4d и¶…е…ұиҪӯж•Ҳеә”
S N 1 жңәеҲ¶зҡ„з«ӢдҪ“еҢ–еӯҰ
S N 1 еҸҚеә”зҡ„з«ӢдҪ“еҢ–еӯҰзү№еҫҒдёҺS N 2 еҸҚеә”зҡ„з«ӢдҪ“еҢ–еӯҰзү№еҫҒжңүеҫҲеӨ§дёҚеҗҢпјҢеҪ“然пјҢиҝҷеҸҜд»Ҙз”ЁSN1жңәеҲ¶еҫҲеҘҪең°и§ЈйҮҠгҖӮ

д»Ҙ (S)-3-жәҙ-3-з”Іеҹәе·ұзғ·еҸҚеә”зү©ејҖе§ӢпјҢS N 1 еҸҚеә”з”ҹжҲҗ 3-з”Іеҹә-3-е·ұйҶҮзҡ„ R е’Ң S еҜ№жҳ дҪ“ 50:50 зҡ„ж··еҗҲзү©пјҢиҝҷжҳҜеӨ–ж¶Ҳж—Ӣж··еҗҲзү©дә§зү©гҖӮиҝҷжҳҜеӣ дёәеңЁS N 1 еҸҚеә”зҡ„第дёҖжӯҘдёӯеҪўжҲҗзҡ„зўіжӯЈзҰ»еӯҗе…·жңүдёүи§’еҪўе№ійқўеҪўзҠ¶гҖӮеҪ“е®ғдёҺдәІж ёиҜ•еүӮеҸҚеә”ж—¶пјҢе®ғеҸҜд»Ҙд»ҺжӯЈйқўжҲ–иғҢйқўиҝӣиЎҢеҸҚеә”пјҢжҜҸдёҖйқўйғҪз»ҷеҮәдёҖз§ҚеҜ№жҳ дҪ“гҖӮдёӨдҫ§еҸ‘з”ҹеҸҚеә”зҡ„еҸҜиғҪжҖ§зӣёзӯүпјҢеӣ жӯӨеҪўжҲҗзӯүйҮҸзҡ„дёӨз§ҚеҜ№жҳ ејӮжһ„дҪ“пјҢдә§зү©дёәеӨ–ж¶Ҳж—Ӣж··еҗҲзү©гҖӮ
е°Ҷе…үеӯҰжҙ»жҖ§еҢ–еҗҲзү©иҪ¬еҢ–дёәеӨ–ж¶Ҳж—ӢеҪўејҸзҡ„еҸҚеә”жҚ®иҜҙжҳҜйҡҸзқҖеӨ–ж¶Ҳж—ӢеҢ–иҝӣиЎҢзҡ„гҖӮеҜ№дәҺд»ҘпјҲе…үеӯҰжҙ»жҖ§пјүдёҖз§ҚеҜ№жҳ дҪ“дҪңдёәеҸҚеә”зү©ејҖе§Ӣдё”жүӢжҖ§дёӯеҝғд№ҹжҳҜдәІз”өеӯҗзўіпјҲеҚіеҸҚеә”еҸ‘з”ҹеңЁжүӢжҖ§дёӯеҝғдёҠпјүзҡ„ S N 1 еҸҚеә”пјҢе®ғдјҡиҝӣиЎҢеӨ–ж¶Ҳж—ӢеҢ–пјҡеҰӮдёҠжүҖзӨәгҖӮ
з»ғд№ 7.3
жҳҫзӨә(S)-3-жәҙ-3-з”Іеҹәе·ұзғ·е’Ңж°ҙзҡ„дёҠиҝ°еҸҚеә”зҡ„иҜҰз»ҶжңәзҗҶгҖӮ
第 7 з« з»ғд№ йўҳзӯ”жЎҲ
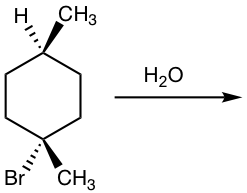
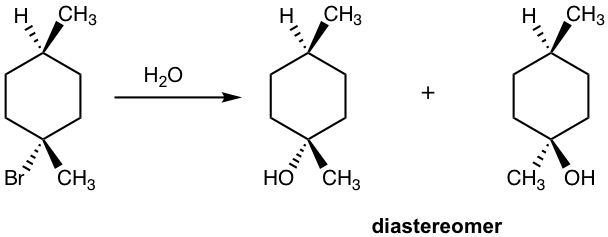
иҜ·жіЁж„ҸпјҢеҰӮжһңеҸҚеә”зү©зҡ„жүӢжҖ§дёӯеҝғдёҚжҳҜеҸҚеә”дёӯеҝғпјҢжҲ–иҖ…еҸҚеә”зү©дёӯеӯҳеңЁеӨҡдёӘжүӢжҖ§дёӯеҝғпјҢеҲҷ S N 1 еҸҚеә”дёҚдјҡдә§з”ҹеӨ–ж¶Ҳж—Ӣж··еҗҲзү©пјҢеҰӮдёӢжүҖзӨәдёӢйқўзҡ„дҫӢеӯҗгҖӮ
дҫӢеӯҗ
жҳҫзӨәд»ҘдёӢ S N 1 еҸҚеә”зҡ„дә§зү©пјҡ
и§ЈеҶіж–№жЎҲпјҡ
зҰ»еҺ»еҹәеӣўеҜ№ S N 1 зҡ„еҪұе“Қ
дёҺ S N 2 еҸҚеә”зҡ„жғ…еҶөдёҖж ·пјҢS N 1 жңәеҲ¶д№ҹйңҖиҰҒиүҜеҘҪзҡ„зҰ»еҺ»еҹәеӣўпјҢжҲ‘们еңЁ 7.3 иҠӮдёӯиҝӣиЎҢзҡ„жүҖжңүи®Ёи®әд»Қ然йҖӮз”ЁгҖӮ
дәІж ёиҜ•еүӮ
дёҺS N 2 еҸҚеә”дёҚеҗҢпјҢS N 1 еҸҚеә”зҡ„йҷҗйҖҹжӯҘйӘӨдёҚеҢ…еҗ«дәІж ёиҜ•еүӮпјҢеӣ жӯӨзҗҶи®әдёҠдәІж ёиҜ•еүӮзҡ„ејәеәҰеҜ№S N 1 дёӘеҸҚеә”гҖӮ然иҖҢпјҢејәдәІж ёиҜ•еүӮжӣҙеҖҫеҗ‘дәҺиҝӣиЎҢ S N 2 еҸҚеә”иҖҢдёҚжҳҜ S N 1пјҢеӣ жӯӨиҫғејұзҡ„дәІж ёиҜ•еүӮжҳҜ S N O жҳҜдәІж ёиҜ•еүӮгҖӮ
е®һйҷ…дёҠпјҢS N 1 еҸҚеә”дёӯйҖҡеёёдҪҝз”ЁдёӯжҖ§зү©иҙЁеҰӮ H 2 OгҖҒROH е’Ң RCOOH дҪңдёәдәІж ёиҜ•еүӮгҖӮеҪ“иҝҷдәӣзү©иҙЁеә”з”ЁдәҺеҸҚеә”ж—¶пјҢе®ғ们иҝҳе…·жңүдҪңдёәжә¶еүӮзҡ„еҸҰдёҖдёӘеҠҹиғҪгҖӮеӣ жӯӨпјҢе®ғ们既用дҪңS N 1 еҸҚеә”зҡ„дәІж ёиҜ•еүӮе’Ңжә¶еүӮпјҢиҝҷз§ҚеҸҚеә”д№ҹз§°дёәжә¶еүӮи§ЈеҸҚеә”гҖӮжә¶еүӮи§ЈеҸҚеә”жҳҜдәІж ёеҸ–д»ЈпјҢе…¶дёӯдәІж ёиҜ•еүӮд№ҹжҳҜжә¶еүӮеҲҶеӯҗгҖӮжңҜиҜӯвҖңжә¶еүӮеҲҶи§ЈвҖқжқҘиҮӘжә¶еүӮ+иЈӮи§ЈпјҢж„ҸжҖқжҳҜиў«жә¶еүӮиЈӮи§ЈгҖӮ S N 1 еҸҚеә”йҖҡеёёжҳҜжә¶еүӮеҲҶи§ЈеҸҚеә”гҖӮ
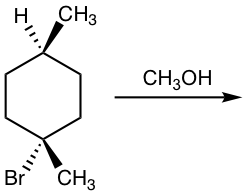
дҫӢеӯҗ
жҳҫзӨәдёӢеҲ—жә¶еүӮеҲҶи§ЈеҸҚеә”зҡ„дә§зү©з»“жһ„гҖӮ
и§ЈеҶіж–№жЎҲпјҡ
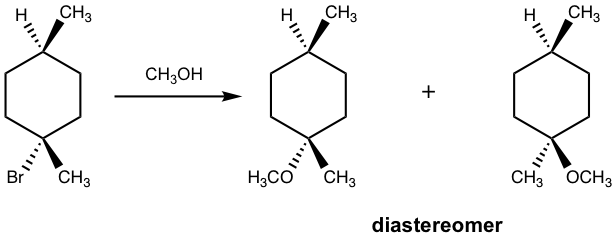
7.5 SN1 дёҺ SN2
7.5.1 S N 1 е’Ң S N 2 еҸҚеә”зҡ„жҜ”иҫғ
иҮіжӯӨпјҢжҲ‘们已з»ҸдәҶи§ЈдәҶS N 1 е’ҢS N 2 еҸҚеә”зҡ„еҹәжң¬жҰӮеҝөгҖӮжӮЁеҸҜиғҪе·Із»ҸжіЁж„ҸеҲ°пјҢиҝҷдёӨз§ҚеҸҚеә”жңүдёҖдәӣзӣёдјјд№ӢеӨ„пјҢдҪҶд№ҹжңүеҫҲеӨ§дёҚеҗҢгҖӮе°Ҷе®ғ们ж”ҫеңЁдёҖиө·иҝӣиЎҢжҜ”иҫғе°Ҷйқһеёёжңүеё®еҠ©гҖӮдёәдәҶеё®еҠ©жӮЁж·ұе…ҘдәҶи§ЈиҝҷдёӨзұ»жңәеҲ¶пјҢејәзғҲе»әи®®жӮЁжҢүз…§иҮӘе·ұзҡ„ж–№ејҸиҝӣиЎҢжҖ»з»“гҖӮиҝҷйҮҢжҸҗдҫӣд»ҘдёӢжҜ”иҫғдҫӣжӮЁеҸӮиҖғгҖӮ
SN1 | SN2 | |
жҜ”зҺҮжі• | йҖҹзҺҮ = k[дәІз”өеӯҗиҜ•еүӮ] | йҖҹзҺҮ = k[дәІж ёиҜ•еүӮ]Г—[дәІз”өеӯҗиҜ•еүӮ] |
жңәеҲ¶ | зўіжӯЈзҰ»еӯҗдёӯй—ҙдҪ“зҡ„еӨҡдёӘжӯҘйӘӨ | дёҖжӯҘдёҖдёӘи„ҡеҚ°пјҢйҪҗеҝғеҚҸеҠӣ |
еҸҚеә”еӣҫ |
|
|
з«ӢдҪ“еҢ–еӯҰ | еҸҚеә”дёӯеҝғеӨ–ж¶Ҳж—Ӣ | еҸҚеә”дёӯеҝғеҸҚиҪ¬ |
дәІз”өеә•зү© | еҸ” 3В° > д»І 2В° > дјҜ 1В° е’Ңз”Іеҹә | дјҜ 1В° е’Ңз”Іеҹә > д»І 2В° > еҸ” 3В° |
дәІж ёиҜ•еүӮ | ејұдәІж ёиҜ•еүӮпјҢжә¶еүӮеҲҶи§Ј | ејәдәІж ёиҜ•еүӮ |
7.5.2 жә¶еүӮеҜ№ Sn1 е’Ң S N 2 еҸҚеә”зҡ„еҪұе“Қ
йҷӨдәҶжҲ‘们еҲ°зӣ®еүҚдёәжӯўи®Ёи®әзҡ„еӣ зҙ д№ӢеӨ–пјҢжә¶еүӮжҳҜеҪұе“ҚдәІж ёеҸ–д»ЈеҸҚеә”зҡ„еҸҰдёҖдёӘе…ій”®еӣ зҙ гҖӮйңҖиҰҒйҖӮеҪ“зҡ„жә¶еүӮжқҘдҝғиҝӣжҹҗз§ҚжңәеҲ¶гҖӮеңЁжҹҗдәӣжғ…еҶөдёӢпјҢйҖүжӢ©еҗҲйҖӮзҡ„жә¶еүӮжҳҜжҺ§еҲ¶еҸҚеә”иҝӣиЎҢи·Ҝеҫ„зҡ„жңүж•Ҳж–№жі•гҖӮ
иҰҒдәҶи§Јжә¶еүӮж•Ҳеә”пјҢжҲ‘们йҰ–е…ҲйңҖиҰҒеҜ№жә¶еүӮиҝӣиЎҢжӣҙиҜҰз»Ҷзҡ„и®Ёи®әпјҢ然еҗҺдәҶи§ЈеҰӮдҪ•дёәзү№е®ҡеҸҚеә”йҖүжӢ©иүҜеҘҪзҡ„жә¶еүӮгҖӮ
ж №жҚ®з»“жһ„е’ҢжһҒжҖ§пјҢжә¶еүӮеҸҜеҲҶдёәдёүеӨ§зұ»пјҡйқһжһҒжҖ§жә¶еүӮгҖҒжһҒжҖ§иҙЁеӯҗжә¶еүӮе’ҢжһҒжҖ§йқһиҙЁеӯҗжә¶еүӮгҖӮ
йқһжһҒжҖ§жә¶еүӮжҳҜйқһжһҒжҖ§еҢ–еҗҲзү©пјҲе·ұзғ·гҖҒиӢҜгҖҒз”ІиӢҜзӯүпјү
жһҒжҖ§иҙЁеӯҗжә¶еүӮжҳҜеҗ«жңүиғҪеӨҹеҪўжҲҗж°ўй”®зҡ„OHжҲ–NHеҹәеӣўзҡ„еҢ–еҗҲзү©гҖӮз”ұдәҺ OH жҲ– NH еҹәеӣўпјҢжһҒжҖ§иҙЁеӯҗжә¶еүӮе…·жңүй«ҳжһҒжҖ§гҖӮ
жһҒжҖ§йқһиҙЁеӯҗжә¶еүӮжҳҜе…·жңүдёӯзӯүжһҒжҖ§иҢғеӣҙзҡ„жә¶еүӮгҖӮе®ғ们жҳҜжһҒжҖ§зҡ„пјҢеӣ дёәжһҒжҖ§й”®еҰӮ C=O жҲ– S=OпјҢдҪҶжһҒжҖ§дёҚеҰӮ OH жҲ– NH еҹәеӣўй«ҳгҖӮжһҒжҖ§йқһиҙЁеӯҗжә¶еүӮзҡ„е…ёеһӢе®һдҫӢеҢ…жӢ¬дёҷй…®гҖҒDMSOгҖҒDMFгҖҒTHFе’ҢCH 2 Cl 2 гҖӮ
жңүе…ідәІж ёеҸ–д»ЈеҸҚеә”зҡ„жә¶еүӮзҡ„дёҖиҲ¬еҮҶеҲҷжҳҜпјҡ
S N 1 еҸҚеә”жңүеҲ©дәҺжһҒжҖ§иҙЁеӯҗжә¶еүӮпјҲH 2 OгҖҒROH зӯүпјүпјҢйҖҡеёёдёәжә¶еүӮеҲҶи§ЈеҸҚеә”гҖӮ
жһҒжҖ§йқһиҙЁеӯҗжә¶еүӮпјҲдёҷй…®гҖҒDMSOгҖҒDMF зӯүпјүжңүеҲ©дәҺ S N 2 еҸҚеә”гҖӮ
жһҒжҖ§иҙЁеӯҗжә¶еүӮжңүеҲ©дәҺ S N 1 еҸҚеә”
еңЁS N 1 еҸҚеә”дёӯпјҢ第дёҖжӯҘжҳҜзҰ»еҺ»еҹәеӣўзҰ»ејҖ并еҪўжҲҗзўіжӯЈзҰ»еӯҗпјҢиҝҷд№ҹжҳҜйҖҹзҺҮеҶіе®ҡжӯҘйӘӨгҖӮжһҒжҖ§жә¶еүӮпјҢеҰӮж°ҙгҖҒMeOHпјҢиғҪеӨҹдёҺ第дёҖжӯҘиҝҮжёЎжҖҒзҡ„зҰ»еҺ»еҹәеӣўеҪўжҲҗж°ўй”®пјҢд»ҺиҖҢйҷҚдҪҺеҪўжҲҗзўіжӯЈзҰ»еӯҗзҡ„иҝҮжёЎжҖҒиғҪйҮҸпјҢеҠ еҝ«йҖҹзҺҮеҶіе®ҡжӯҘйӘӨгҖӮз»“жһңпјҢжһҒжҖ§иҙЁеӯҗжә¶еүӮдҝғиҝӣS N 1 еҸҚеә”гҖӮжһҒжҖ§иҙЁеӯҗжә¶еүӮд№ҹе……еҪ“ S N 1 еҸҚеә”зҡ„дәІж ёиҜ•еүӮжҳҜеҫҲеёёи§Ғзҡ„пјҢеӣ жӯӨ S N 1 еҸҚеә”йҖҡеёёжҳҜжә¶еүӮи§ЈеҸҚеә”пјҢжӯЈеҰӮжҲ‘们д№ӢеүҚдәҶи§ЈеҲ°зҡ„гҖӮ

еӣҫ 7.5a иҙЁеӯҗжә¶еүӮпјҲдҫӢеҰӮ H2Oпјүдҝғиҝӣ S N 1 еҸҚеә”дёӯзўіжӯЈзҰ»еӯҗдёӯй—ҙдҪ“зҡ„еҪўжҲҗ
жһҒжҖ§йқһиҙЁеӯҗжә¶еүӮжңүеҲ©дәҺ S N 2 еҸҚеә”
S N 2 еҸҚеә”йңҖиҰҒејәдәІж ёиҜ•еүӮпјҢејәдәІж ёиҜ•еүӮйҖҡеёёжҳҜеёҰиҙҹз”өзҡ„зү©иҙЁпјҢеҰӮ OH вҖ“ гҖҒCH 3 O вҖ“ гҖӮиҝҷдәӣйҳҙзҰ»еӯҗеҝ…йЎ»д»ҘзӣҗеҪўејҸдёҺйҳізҰ»еӯҗдёҖиө·еӯҳеңЁпјҢдҫӢеҰӮ NaOH жҲ– CH 3 ONaгҖӮз”ұдәҺзӣҗдёҚжә¶дәҺйқһжһҒжҖ§жә¶еүӮпјҢеӣ жӯӨйқһжһҒжҖ§жә¶еүӮдёҚжҳҜеҗҲйҖӮзҡ„йҖүжӢ©пјҢжҲ‘们йңҖиҰҒеҸҜд»Ҙжә¶и§Јзӣҗзҡ„жһҒжҖ§жә¶еүӮгҖӮ
жһҒжҖ§иҙЁеӯҗжә¶еүӮзҡ„й—®йўҳжҳҜдәІж ёйҳҙзҰ»еӯҗе°Ҷиў«дёҖеұӮе…·жңүж°ўй”®зҡ„жә¶еүӮеҲҶеӯҗеҢ…еӣҙпјҢиҝҷз§°дёәжә¶еүӮеҢ–ж•Ҳеә”гҖӮжә¶еүӮеҢ–ж•Ҳеә”зЁіе®ҡпјҲжҲ–йҳ»зўҚпјүдәІж ёиҜ•еүӮ并йҳ»зўҚе®ғ们еңЁ S N 2 еҸҚеә”дёӯзҡ„еҸҚеә”жҖ§гҖӮеӣ жӯӨпјҢжһҒжҖ§иҙЁеӯҗжә¶еүӮдёҚйҖӮеҗҲS N 2 еҸҚеә”гҖӮ
еӣҫ 7.5b иҙЁеӯҗжә¶еүӮеҜ№ SN2 дёҚиө·дҪңз”ЁпјҡдәІж ёиҜ•еүӮиў«иҙЁеӯҗжә¶еүӮжә¶еүӮеҢ–并еҸ—йҳ»
еӣ жӯӨпјҢдёҷй…®е’ҢDMSOзӯүжһҒжҖ§йқһиҙЁеӯҗжә¶еүӮжҳҜS N 2 еҸҚеә”зҡ„жңҖдҪійҖүжӢ©гҖӮе®ғ们зҡ„жһҒжҖ§и¶ід»Ҙжә¶и§ЈзӣҗеҪўејҸзҡ„дәІж ёиҜ•еүӮпјҢ并且е®ғ们д№ҹдёҚдјҡдёҺйҳҙзҰ»еӯҗејәзғҲзӣёдә’дҪңз”Ёд»Ҙйҳ»зўҚе…¶еҸҚеә”жҙ»жҖ§гҖӮдәІж ёйҳҙзҰ»еӯҗд»Қ然еңЁжһҒжҖ§йқһиҙЁеӯҗжә¶еүӮдёӯиҮӘз”ұ移еҠЁпјҢе……еҪ“дәІж ёиҜ•еүӮгҖӮ
S N 2 еҸҚеә”еңЁдёҚеҗҢжә¶еүӮдёӯзҡ„еҸҚеә”йҖҹзҺҮеҰӮдёӢиЎЁжүҖзӨәпјҢжһҒжҖ§йқһиҙЁеӯҗжә¶еүӮDMFиў«иҜҒжҳҺжҳҜжҳҫзқҖеҠ йҖҹеҸҚеә”зҡ„жңҖдҪійҖүжӢ©гҖӮ
еҸҚеә”пјҡCH 3 I + Cl вҖ“ В вҶ’ CH 3 Cl + I вҖ“ | |
жә¶еүӮ | зӣёеҜ№зҺҮ |
CH 3 зҫҹеҹә | 1 |
| 12.5 |
| 1,200,000 |
7.5.3 еҸҚеә”йҖ”еҫ„зҡ„йҖүжӢ©пјҡS N 1иҝҳжҳҜS N 2пјҹ
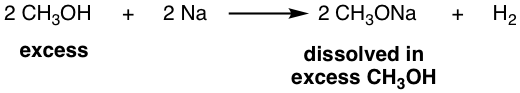
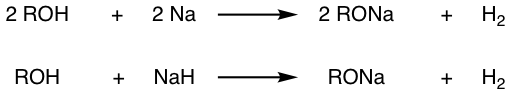
жңүдәҶжҲ‘们жүҖдәҶи§Јзҡ„жңүе…і S N 1гҖҒS N 2 еҸҚеә”е’ҢеҸҚеә”жқЎд»¶зҡ„жүҖжңүзҹҘиҜҶпјҢжҲ‘们еә”иҜҘиғҪеӨҹзЎ®е®ҡз»ҷе®ҡзҡ„еҸҚеә”жҳҜеҗҰдёҺ S N 2 йҖ”еҫ„жҲ–и®ҫи®ЎйҖӮеҪ“зҡ„еҸҚеә”жқҘдә§з”ҹжүҖйңҖзҡ„дә§зү©гҖӮеҸҚеә”йҖ”еҫ„дё»иҰҒеҸ–еҶідәҺеә•зү©зҡ„жҖ§иҙЁпјҲдёҖзә§гҖҒдәҢзә§жҲ–дёүзә§пјүпјҢйҖүжӢ©йҖӮеҪ“зҡ„еҸҚеә”жқЎд»¶жҳҜдҝғиҝӣиҜҘиҝҮзЁӢзҡ„дёҖз§Қж–№ејҸгҖӮ
еҲқзә§еә•зү©е’Ңз”Іеҹәеә•зү©дё»иҰҒеҸ‘з”ҹ S N 2 еҸҚеә”гҖӮ
第дёүеұӮеҹәжқҗйҮҮз”ЁS N 1 е·ҘиүәгҖӮ
ж¬Ўзә§еә•зү©зҡ„еҸҚеә”дё»иҰҒеҸ–еҶідәҺжүҖж–ҪеҠ зҡ„жқЎд»¶гҖӮжқЎд»¶еҢ…жӢ¬дәІж ёиҜ•еүӮгҖҒжә¶еүӮзӯүгҖӮжңүе…іжӣҙиҜҰз»Ҷзҡ„и®Ёи®әпјҢиҜ·еҸӮйҳ…зӨәдҫӢгҖӮ
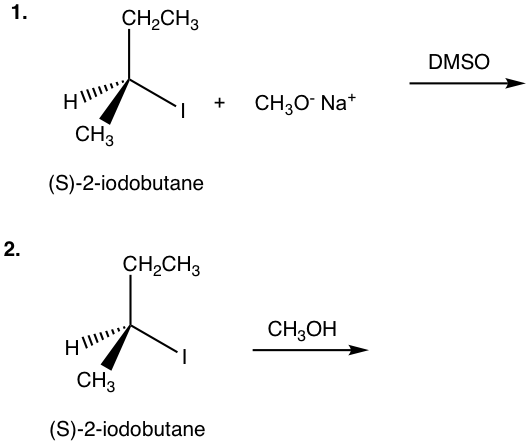
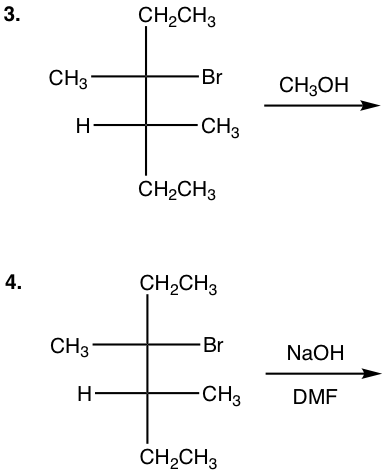
з»ғд№ 7.4
жҳҫзӨәдёӢеҲ—еҸҚеә”зҡ„дә§зү©пјҡ
(S)-2-зўҳдёҒзғ· + CH 3 O вҖ“ Na + (DMSO вҶ’_
(S)-2-зўҳдёҒзғ· (CH 3 OH вҶ’_
第 7 з« з»ғд№ йўҳзӯ”жЎҲ
жңүе…і S N 1 е’Ң S N 2 еҸҚеә”зҡ„дёҖдәӣе®һз”ЁжҠҖе·§пјҡ
жҚ®жҲ‘们дәҶи§ЈпјҢS N 2 еҸҚеә”йңҖиҰҒејәдәІж ёиҜ•еүӮпјҢиҖҢејәдәІж ёиҜ•еүӮеӨ§еӨҡж•°жҳҜеёҰиҙҹз”өиҚ·зҡ„пјҢдҫӢеҰӮ OH вҖ“ е’Ң OR вҖ“ гҖҒ CH 3 O вҖ“ гҖҒ C 2 H5O вҖ“ пјҢжҲ–еңЁеҸҚеә”жқЎд»¶дёӢд»ҘзӣҗеҪўејҸеҰӮNaOHгҖҒKOHгҖҒCH 3 ONaжҲ–C 2 H 5 ONaгҖӮдҪ еә”иҜҘжҳҺзҷҪпјҢиҝҷжҳҜеҗҢдёҖ件дәӢгҖӮйҳҙзҰ»еӯҗеҪўејҸжҳ“дәҺиҜҶеҲ«пјҢд№ҹзӘҒеҮәдәҶиҝҷдәӣзү©з§Қзҡ„жҖ§иҙЁпјӣ然иҖҢпјҢз”ұдәҺйҳҙзҰ»еӯҗеҝ…йЎ»дёҺжҠ—иЎЎйҳізҰ»еӯҗд»Ҙзӣҗзҡ„еҪўејҸе‘ҶеңЁдёҖиө·пјҢеӣ жӯӨзӣҗж јејҸжҳҫзӨәдәҶеҸҚеә”дёӯжүҖз”ЁеҢ–еҗҲзү©зҡ„е®һйҷ…еҢ–еӯҰејҸгҖӮ
з”ұдәҺжһҒжҖ§йқһиҙЁеӯҗжә¶еүӮжңүеҲ©дәҺS N 2 еҸҚеә”пјҢеӣ жӯӨдёҠиҝ°д»»дҪ•йҳҙзҰ»еӯҗжҲ–зӣҗйғҪеҸҜд»ҘдёҺDMSOгҖҒDMFзӯүдёҖиө·дҪҝз”ЁпјҢдҫӢеҰӮOH вҖ“ /DMSOжҲ–CH 3 ONa/DMFгҖӮ然иҖҢпјҢжңүж—¶жӮЁеҸҜиғҪдјҡзңӢеҲ°зұ»дјј CH 3 ONa/CH 3 OH зҡ„з»„еҗҲпјҢе®ғжҳҜ CH 3 OвҖ“ дёҺе…¶е…ұиҪӯй…ё CH зҡ„з»„еҗҲ 3 е“ҰгҖӮиҝҷдјјд№ҺжҳҜзҹӣзӣҫзҡ„пјҢйӮЈд№Ҳдёәд»Җд№Ҳ SN 2 зҡ„ејәдәІж ёиҜ•еүӮдёҺ SN 1 зҡ„жә¶еүӮз»“еҗҲпјҹе®һйҷ…жғ…еҶөжҳҜпјҢиҝҷйҮҢзҡ„ CH 3 ONa д»Қ然充еҪ“ејәдәІж ёиҜ•еүӮпјҢеҸҜз”ЁдәҺ SN 2 еҸҚеә”пјҢиҖҢ CH 3 OH жҳҜ CH зҡ„жә¶еүӮ 3 еҘҘзәігҖӮд№ӢжүҖд»ҘеҗҢж—¶дҪҝз”ЁCH 3 OHдҪңдёәжә¶еүӮпјҢжҳҜеӣ дёәCH3ONaеҸҜд»ҘйҖҡиҝҮз”ЁNaеӨ„зҗҶйҶҮжқҘеҲ¶еӨҮгҖӮдҫӢеҰӮпјҡ
е…¶д»–йҶҮд№ҹеҸҜд»ҘдёҺйҮ‘еұһй’ пјҲжҲ–йҮ‘еұһй’ҫпјҢKпјүеҸҚеә”з”ҹжҲҗзӣёеә”зҡ„RONaгҖӮ
д№ҹеҸҜд»ҘдҪҝз”ЁйҶҮе’ҢNaHд№Ӣй—ҙзҡ„еҸҚеә”гҖӮ
 з”ұдәҺдёҠиҝ°еҸҚеә”дёӯйҶҮиҝҮйҮҸпјҢеӣ жӯӨе®ғд№ҹжҳҜжүҖеҫ—йҶҮзӣҗзҡ„иүҜеҘҪжә¶еүӮпјҢйҖҡеёёдёҖиө·дҪҝз”ЁRO вҖ“ /ROHз»„еҗҲгҖӮиҜҘз»„еҗҲдёӯзҡ„ RO вҖ“ еҸҜз”ЁдҪң S N 2 еҸҚеә”зҡ„ејәдәІж ёиҜ•еүӮжҲ–ж¶ҲйҷӨеҸҚеә”дёӯзҡ„зўұпјҲ第 8 з« пјүгҖӮ
з”ұдәҺдёҠиҝ°еҸҚеә”дёӯйҶҮиҝҮйҮҸпјҢеӣ жӯӨе®ғд№ҹжҳҜжүҖеҫ—йҶҮзӣҗзҡ„иүҜеҘҪжә¶еүӮпјҢйҖҡеёёдёҖиө·дҪҝз”ЁRO вҖ“ /ROHз»„еҗҲгҖӮиҜҘз»„еҗҲдёӯзҡ„ RO вҖ“ еҸҜз”ЁдҪң S N 2 еҸҚеә”зҡ„ејәдәІж ёиҜ•еүӮжҲ–ж¶ҲйҷӨеҸҚеә”дёӯзҡ„зўұпјҲ第 8 з« пјүгҖӮ
7.6 дәІж ёеҸ–д»ЈеҸҚеә”зҡ„йўқеӨ–дё»йўҳ
еҲ°зӣ®еүҚдёәжӯўпјҢжҲ‘们зҡ„и®Ёи®әдё»иҰҒйӣҶдёӯеңЁ SN1 е’Ң SN2 жңәеҲ¶зҡ„еҹәжң¬жҰӮеҝөдёҠпјҢ并且жҲ‘们дәҶи§ЈеҲ°зҡ„еҸҚеә”д»Ҙ常规方ејҸиҝӣиЎҢгҖӮеҸҜд»ҘеңЁеҹәжң¬дәІж ёеҸ–д»ЈеҸҚеә”дёӯвҖңж·»еҠ вҖқдёҖдәӣе…¶д»–жқЎд»¶пјҢд»ҘдҪҝеҸҚеә”зңӢиө·жқҘдёҚеҗҢжҲ–жӣҙе…·жңүжҢ‘жҲҳжҖ§гҖӮ然иҖҢпјҢеҫҲеҘҪең°зҗҶи§Јеҹәжң¬жҰӮеҝөеҜ№дәҺжҲ‘们еӨ„зҗҶеҗ„з§Қжғ…еҶөжҳҜйқһеёёжңүеё®еҠ©зҡ„гҖӮеҸҚеә”еҸҜиғҪзңӢиө·жқҘдёҚеҗҢпјҢдҪҶжң¬иҙЁдёҠиҝҳжҳҜдёҖж ·зҡ„гҖӮ
7.6.1 S N 1 зўіжӯЈзҰ»еӯҗйҮҚжҺ’еҸҚеә”
и®©жҲ‘们зңӢдёҖдёӢ S N 1 еҸҚеә”гҖӮ
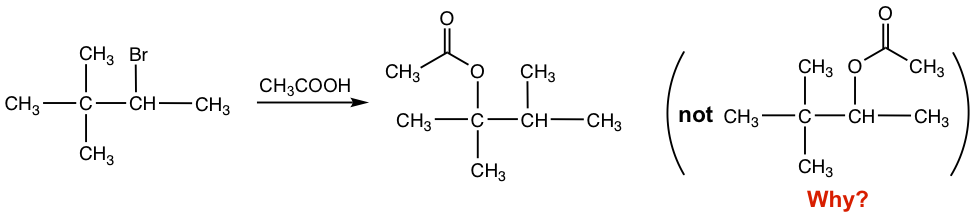
еӣҫ 7.6a зўіжӯЈзҰ»еӯҗйҮҚжҺ’еҸҚеә”
дёҺ第дәҢеә•зү©е’ҢдёӯжҖ§дәІж ёиҜ•еүӮпјҲCH 3 COOHпјүдёҖиө·пјҢиҝҷжҳҜдёҖдёӘ S N 1 еҸҚеә”пјҢд№ҹжҳҜ CH 3 COOH ж—ўе……еҪ“жә¶еүӮе’ҢдәІж ёиҜ•еүӮгҖӮйў„и®Ўдјҡдә§з”ҹд№ҷй…ёзӣҗдҪңдёәдә§зү©пјҢе…¶дёӯд№ҷй…ёзӣҗеҸ–д»ЈдәҶжәҙгҖӮ然иҖҢпјҢеҰӮеҸҚеә”ж–№зЁӢејҸжүҖзӨәпјҢд№ҷй…ёй…Ҝ并жңӘеј•е…ҘеҲ°е…·жңүзҰ»еҺ»еҹәеӣўBrзҡ„зўідёҠпјҢиҖҢжҳҜиҝһжҺҘеҲ°дёӢдёҖдёӘзўідёҠгҖӮдә§е“Ғз»“жһ„еҮәзҺ°ж„ҸеӨ–зҡ„еҺҹеӣ жҳҜд»Җд№Ҳпјҹ
еҜ№дәҺж¶үеҸҠзўіжӯЈзҰ»еӯҗдёӯй—ҙдҪ“зҡ„еҸҚеә”пјҢеёёи§Ғзҡ„зҺ°иұЎжҳҜзўіжӯЈзҰ»еӯҗеҸҜиғҪдјҡйҮҚжҺ’пјҢеҰӮжһңиҝҷз§ҚйҮҚжҺ’еҜјиҮҙжӣҙзЁіе®ҡзҡ„зўіжӯЈзҰ»еӯҗпјӣиҝҷз§°дёәзўій…ёеҢ–йҮҚжҺ’гҖӮз”ұдәҺзўійҳізҰ»еӯҗйҮҚжҺ’пјҢдёҠиҝ°еҸҚеә”зҡ„дә§зү©дёҺйў„жңҹдёҚеҗҢгҖӮиҝҷеҸҜд»ҘйҖҡиҝҮдёӢйқўзҡ„еҲҶжӯҘжңәеҲ¶жқҘи§ЈйҮҠгҖӮ

еӣҫ 7.6b йҖҗжӯҘзўіжӯЈзҰ»еӯҗйҮҚжҺ’
еҪ“ Br вҖ“ зҰ»ејҖж—¶пјҢжңҖеҲқеҪўжҲҗзҡ„зўіжӯЈзҰ»еӯҗжҳҜдәҢж¬ЎзўіжӯЈзҰ»еӯҗгҖӮ然еҗҺпјҢдёӢдёҖдёӘзўідёҠзҡ„ CH 3 еҹәеӣўе°Ҷе…¶й”®еҗҲз”өеӯҗиҪ¬з§»еҲ°еёҰжӯЈз”өзҡ„зўідёҠпјҢ并дә§з”ҹж–°зҡ„гҖҒжӣҙзЁіе®ҡзҡ„еҸ”зўіжӯЈзҰ»еӯҗгҖӮ然еҗҺеҸ”зўійҳізҰ»еӯҗдёҺдәІж ёиҜ•еүӮCH 3 COOH еҸҚеә”пјҢеҫ—еҲ°жңҖз»Ҳзҡ„д№ҷй…ёй…Ҝдә§зү©гҖӮ CH 3 еҹәеӣўйҡҸз”өеӯҗеҜ№з§»еҠЁпјҢиҝҷз§Қ移еҠЁз§°дёә1,2-з”Ізғ·еҢ–зү©з§»еҠЁгҖӮиҝҷйҮҢзҡ„вҖң1,2-вҖқжҳҜжҢҮдёӨдёӘзӣёйӮ»зўід№Ӣй—ҙеҸ‘з”ҹзҡ„移еҠЁпјҢдҪҶдёҚдёҖе®ҡжҳҜC1е’ҢC2гҖӮ
йҷӨдәҶ CH 3 еҹәеӣўд№ӢеӨ–пјҢе…¶д»–еҸҚеә”дёӯзҡ„ H еҺҹеӯҗд№ҹеҸҜд»ҘйҡҸз”өеӯҗеҜ№з§»еҠЁпјҢеҰӮжһңиҝҷз§Қ移еҠЁеҸҜд»ҘеҜјиҮҙжӣҙзЁіе®ҡзҡ„зўіжӯЈзҰ»еӯҗгҖӮж°ўзҡ„иҪ¬еҸҳз§°дёә1,2-ж°ўеҢ–зү©иҪ¬еҸҳгҖӮе…ідәҺзўіжӯЈзҰ»еӯҗйҮҚжҺ’зҡ„дёҖдәӣжіЁж„ҸдәӢйЎ№пјҡ
д»»дҪ•ж¶үеҸҠзўійҳізҰ»еӯҗдёӯй—ҙдҪ“зҡ„еҸҚеә”йғҪеҸҜиғҪеҸ‘з”ҹйҮҚжҺ’гҖӮ
并йқһжүҖжңүзўіжӯЈзҰ»еӯҗйғҪдјҡйҮҚж–°жҺ’еҲ—гҖӮеҸӘжңүеҪ“зўіжӯЈзҰ»еӯҗеӣ йҮҚжҺ’иҖҢеҸҳеҫ—жӣҙеҠ зЁіе®ҡж—¶пјҢе®ғ们жүҚдјҡйҮҚжҺ’гҖӮ
иҜҘдҪҚ移йҖҡеёёжҳҜ 1,2-дҪҚ移пјҢиҝҷж„Ҹе‘ізқҖе®ғеҸ‘з”ҹеңЁдёӨдёӘзӣёйӮ»зўід№Ӣй—ҙгҖӮ
7.6.2 еҲҶеӯҗеҶ…дәІж ёеҸ–д»ЈеҸҚеә”
еҜ№дәҺжҲ‘们д№ӢеүҚдәҶи§Јзҡ„еҸҚеә”пјҢеёҰжңүзҰ»еҺ»еҹәеӣўзҡ„еә•зү©е’ҢдәІж ёиҜ•еүӮе§Ӣз»ҲжҳҜдёӨз§ҚеҚ•зӢ¬зҡ„еҢ–еҗҲзү©гҖӮе®һйҷ…дёҠпјҢдёҖз§ҚеҢ–еҗҲзү©еҸҜиғҪеҗҢж—¶еҗ«жңүзҰ»еҺ»еҹәеӣўе’ҢдәІж ёеҹәеӣўпјҢ并且еҸҚеә”еҸ‘з”ҹеңЁеҗҢдёҖеҲҶеӯҗеҶ…гҖӮиҝҷз§ҚеҸҚеә”з§°дёәеҲҶеӯҗеҶ…пјҲintraпјҢжӢүдёҒиҜӯвҖңеҶ…йғЁвҖқпјүеҸҚеә”гҖӮзҺҜзҠ¶дә§зү©з”ұеҲҶеӯҗеҶ…еҸҚеә”иҺ·еҫ—гҖӮ
жҲ‘们жқҘи°Ҳи°ҲдҪҝд»ҘдёӢеҸҚеә”зҡ„дә§зү©з»“жһ„е’Ңз«ӢдҪ“еҢ–еӯҰеҗҲзҗҶеҢ–зҡ„еҸҚеә”жңәзҗҶгҖӮ
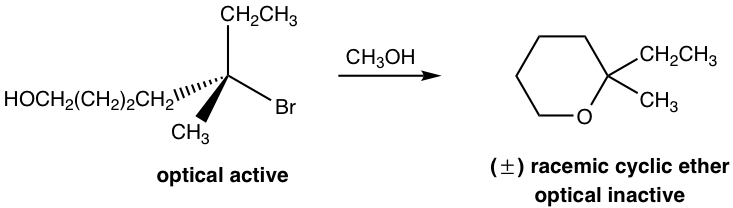
еӣҫ 7.6c еҲҶеӯҗеҶ…дәІж ёеҸ–д»ЈеҸҚеә”

еӣҫ7.6d еҲҶеӯҗеҶ…жңәеҲ¶
еңЁдёҠиҝ°еҸҚеә”дёӯпјҢеҸҚеә”зү©е…·жңүдёӨдёӘе®ҳиғҪеӣўпјҡжәҙпјҲBrпјүе’ҢйҶҮпјҲOHпјүгҖӮе…·жңүдёӨдёӘе®ҳиғҪеӣўзҡ„еҢ–еҗҲзү©з§°дёәеҸҢе®ҳиғҪеҲҶеӯҗгҖӮеңЁиҜҘеҸҚеә”зү©дёӯпјҢBr иҝһжҺҘеңЁеҸ”зўідёҠпјҢиҝҷжҳҜ S N 1 еҸҚеә”зҡ„иүҜеҘҪеә•зү©пјҢ并且 OH д№ҹжҳҜ S N 1 еҸҚеә”зҡ„иүҜеҘҪдәІж ёиҜ•еүӮпјҢеӣ жӯӨеҸ–д»ЈеҸҚеә”еҸҜд»ҘйҖҡиҝҮS N 1 жңәеҲ¶еңЁеҗҢдёҖеҲҶеӯҗеҶ…еҸ‘з”ҹгҖӮеӣ жӯӨпјҢеҸҚеә”еҸ‘з”ҹеңЁдҪңдёәзҰ»еҺ»еҹәеӣўзҡ„еҲҶеӯҗдёҖз«Ҝ Br е’ҢдҪңдёәдәІж ёиҜ•еүӮзҡ„еҲҶеӯҗеҸҰдёҖйғЁеҲҶ OH д№Ӣй—ҙгҖӮз»“жһңпјҢеҪўжҲҗе…ӯе…ғзҺҜйҶҡдҪңдёәдә§зү©гҖӮ
з”ұдәҺеҸҚеә”д»ҘS N 1 жңәзҗҶеҸ‘з”ҹпјҢзўійҳізҰ»еӯҗдёӯй—ҙдҪ“е‘Ҳдёүи§’еҪўе№ійқўеҪўзҠ¶пјҢдәІж ёиҜ•еүӮеҸҜд»Ҙд»ҺзўійҳізҰ»еӯҗзҡ„д»»дёҖдҫ§иҝӣж”»пјҢеҫ—еҲ°дёӨз§ҚеҜ№жҳ дҪ“гҖӮеӣ жӯӨпјҢиҜҘдә§зү©жҳҜдёҖз§ҚдёҚе…·жңүе…үеӯҰжҙ»жҖ§зҡ„еӨ–ж¶Ҳж—Ӣж··еҗҲзү©гҖӮиҝҷдёҺжҲ‘们д№ӢеүҚдәҶи§Јзҡ„S N 1 еҸҚеә”зҡ„з«ӢдҪ“еҢ–еӯҰзү№еҫҒжҳҜдёҖиҮҙзҡ„гҖӮ
йҖҡеёёпјҢеҰӮжһңеҲҶеӯҗеҶ…еҸҚеә”иғҪеӨҹз”ҹжҲҗдә”е…ғзҺҜжҲ–е…ӯе…ғзҺҜдҪңдёәдә§зү©пјҢеҲҷз”ұдәҺдә”е…ғзҺҜжҲ–е…ӯе…ғзҺҜзҡ„зү№ж®ҠзЁіе®ҡжҖ§пјҢиҜҘеҸҚеә”е°ҶеҸ—еҲ°й«ҳеәҰйқ’зқҗгҖӮ
7.6.3 е°Ҷе·®зҰ»еҺ»зҫӨиҪ¬жҚўдёәеҘҪзҰ»еҺ»зҫӨ
еңЁе…ідәҺзҰ»еҺ»еҹәеӣўзҡ„ж—©жңҹи®Ёи®әдёӯпјҲ第 7.3 иҠӮпјүпјҢжҲ‘们жҸҗеҲ°дәҶиүҜеҘҪзҡ„зҰ»еҺ»еҹәеӣўеҜ№дәҺ SN1 е’Ң SN2 еҸҚеә”зҡ„йҮҚиҰҒжҖ§пјҢ并且еҰӮжһңеӯҳеңЁдёҚиүҜзҡ„зҰ»еҺ»еҹәеӣўпјҢеҲҷдёҚдјҡеҸ‘з”ҹеҸ–д»ЈеҸҚеә”гҖӮ然иҖҢпјҢеңЁжҹҗдәӣжғ…еҶөдёӢпјҢдёҚиүҜзҡ„зҰ»еҺ»еҹәеӣўеҸҜд»ҘиҪ¬еҢ–дёәиүҜеҘҪзҡ„зҰ»еҺ»еҹәеӣўд»ҘдҪҝеҸҚеә”еҸҜиЎҢгҖӮжҲ‘们е°ҶзңӢеҲ°дёҖдәӣз”ЁдәҺе®һзҺ°иҝҷдёҖзӣ®зҡ„зҡ„зӯ–з•ҘгҖӮ
йҖҡиҝҮй…ёеӮ¬еҢ–еүӮ H +
зӨәдҫӢпјҡжҸҗеҮәдҪҝеҸҚеә”еҗҲзҗҶеҢ–зҡ„жңәеҲ¶гҖӮ
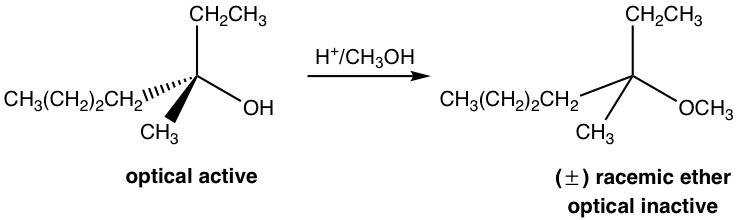
еӣҫ 7.6e еҸҚеә”
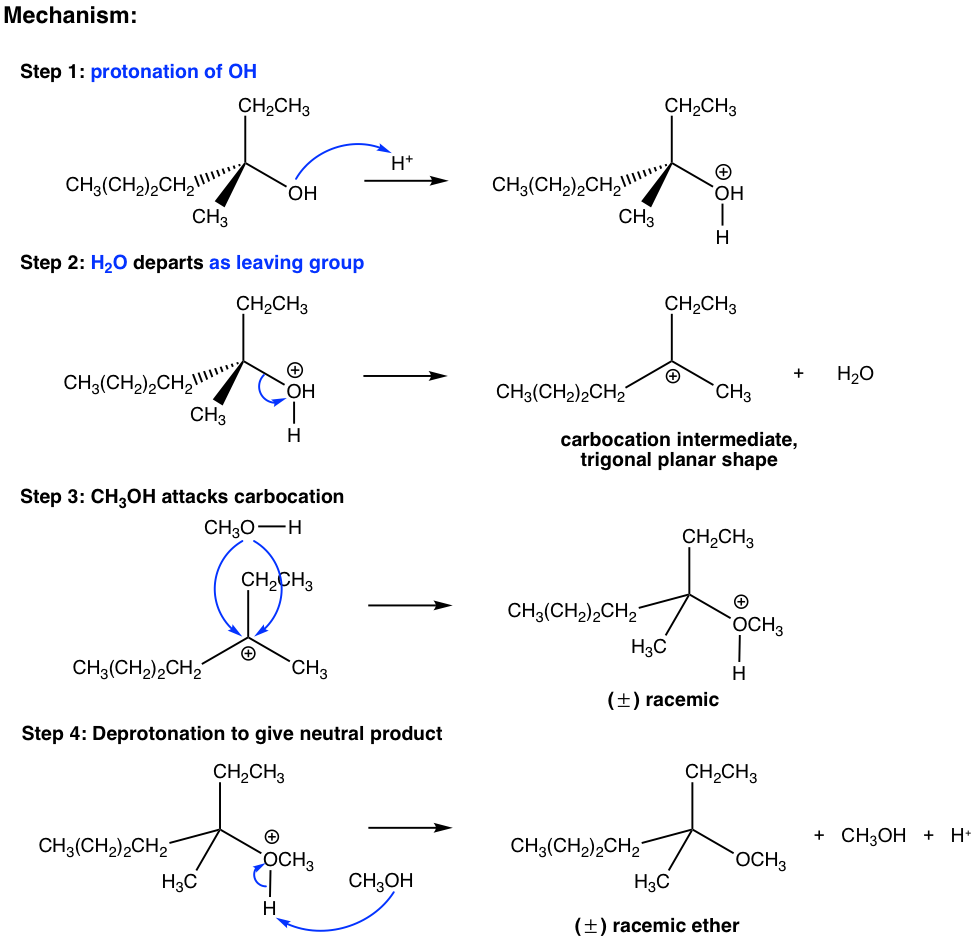
еӣҫ 7.6f жңәеҲ¶
дёҠиҝ°жңәеҲ¶дёӯзҡ„жңҖеҗҺдёүдёӘжӯҘйӘӨжҳҜS N 1жңәеҲ¶зҡ„ж ҮеҮҶжӯҘйӘӨгҖӮ然иҖҢпјҢеҰӮжһңжІЎжңү第дёҖжӯҘпјҢеҸҚеә”е°ұдёҚдјҡиҝӣиЎҢгҖӮ第дёҖжӯҘжҳҜй…ёзўұеҸҚеә”пјҢиҙЁеӯҗеҝ«йҖҹиҪ¬з§»еҲ° OH еҹәеӣўпјҢйҶҮиў«иҙЁеӯҗеҢ–гҖӮйҖҡиҝҮиҙЁеӯҗеҢ–пјҢOHеҹәеӣўиҪ¬еҢ–дёәH 2 OпјҢиҝҷжҳҜдёҖдёӘејұеҫ—еӨҡзҡ„зўұеҹәпјҢеӣ жӯӨжҳҜдёҖдёӘеҫҲеҘҪзҡ„зҰ»еҺ»еҹәеӣўгҖӮеңЁжӯҘйӘӨ 2 дёӯпјҢж°ҙеҲҶеӯҗдёҺз”өеӯҗеҜ№дёҖиө·зҰ»ејҖ并з•ҷдёӢзўійҳізҰ»еӯҗдёӯй—ҙдҪ“гҖӮд»ҘдёӢжӯҘйӘӨеҸӘжҳҜS N 1пјҢиҝҷи§ЈйҮҠдәҶдёәд»Җд№Ҳдә§зү©жҳҜеӨ–ж¶Ҳж—Ӣж··еҗҲзү©гҖӮй…ёH + еңЁжӯҘйӘӨ4дёӯеҶҚз”ҹпјҢеҸҜд»ҘйҮҚж–°з”ЁдәҺиҝӣдёҖжӯҘзҡ„еҸҚеә”пјӣеӣ жӯӨпјҢеҗҜеҠЁиҜҘиҝҮзЁӢеҸӘйңҖиҰҒеӮ¬еҢ–йҮҸзҡ„ H+гҖӮ
зЈәй…°ж°Ҝ
еҸҰдёҖз§Қеёёз”Ёзҡ„е°Ҷ OH еҹәеӣўиҪ¬еҢ–дёәжӣҙеҘҪзҡ„зҰ»еҺ»еҹәеӣўзҡ„ж–№жі•жҳҜеј•е…ҘзЈәй…ёй…ҜгҖӮеҪ“йҶҮдёҺзЈәй…°ж°ҜеңЁејұзўұеӯҳеңЁдёӢеҸҚеә”ж—¶пјҢз”ҹжҲҗзЈәй…ёй…ҜгҖӮ
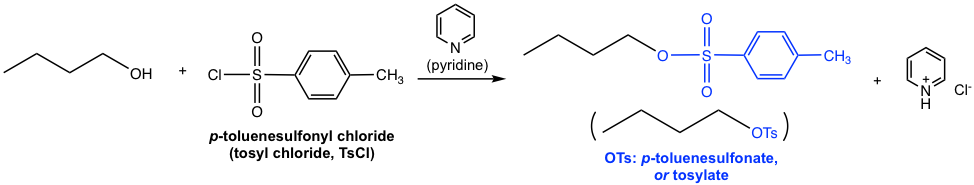
еӣҫ7.6g йҶҮдёҺз”ІиӢҜзЈәй…°ж°ҜеҸҚеә”з”ҹжҲҗз”ІиӢҜзЈәй…ёзӣҗ
еҰӮдёҠдҫӢжүҖзӨәпјҢеҪ“дҪҝз”ЁеҜ№з”ІиӢҜзЈәй…°ж°ҜпјҲз”ІиӢҜзЈәй…°ж°ҜпјҢTsClпјүж—¶пјҢжүҖеҫ—й…ҜдёәеҜ№з”ІиӢҜзЈәй…ёй…ҜпјҲз”ІиӢҜзЈәй…ёй…ҜпјҢOTsпјүгҖӮжӮЁи§үеҫ—з”ІиӢҜзЈәй…°еҹәеҫҲзҶҹжӮүеҗ—пјҹжӯЈеҰӮжҲ‘们еңЁз¬¬ 3.2 иҠӮдёӯдәҶи§Јзҡ„иҝҷдёӘзү©з§ҚдёҖж ·пјҢе®ғеә”иҜҘеҰӮжӯӨгҖӮдҪңдёәејәй…ёжҖ§еҜ№з”ІиӢҜзЈәй…ё (TsOH) зҡ„е…ұиҪӯзўұпјҢOTs жҳҜдёҖз§Қйқһеёёејұзҡ„зўұпјҢеӣ жӯӨжҳҜдёҖз§ҚдјҳејӮзҡ„зҰ»еҺ»еҹәеӣўгҖӮеҗЎе•¶еңЁиҝҷйҮҢе……еҪ“ејұзўұжқҘдёӯе’ҢеүҜдә§зү©HCl并дҝғиҝӣеҸҚеә”е®ҢжҲҗгҖӮжң¬иҜҫзЁӢдёҚйңҖиҰҒиҜҘеҸҚеә”зҡ„иҜҰз»ҶжңәеҲ¶гҖӮ
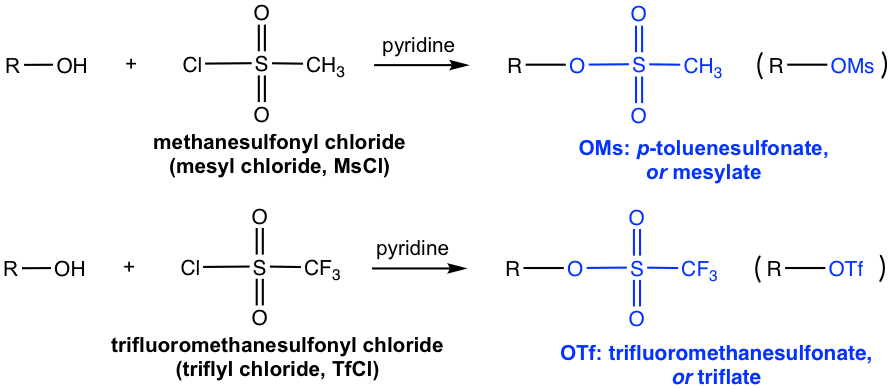
йҷӨеј•е…ҘOTsеӨ–пјҢе…¶д»–еёёз”Ёзҡ„зЈәй…°ж°ҜеҢ…жӢ¬MsClе’ҢTfClпјҢеҲҶеҲ«еҪўжҲҗзЈәй…ёй…ҜOMsпјҲз”ІзЈәй…ёй…Ҝпјүе’ҢOTfпјҲдёүж°ҹз”ІзЈәй…ёй…ҜпјүгҖӮ
еӣҫ 7.6h й…’зІҫиҪ¬еҢ–дёәз”ІзЈәй…ёзӣҗжҲ–дёүж°ҹз”ІзЈәй…ёзӣҗ
дёҖж—ҰдјҜйҶҮиҪ¬еҢ–дёә OTпјҲжҲ– OMпјҢOTfпјүпјҢе®ғе°ұжҲҗдёә S N 2 еҸҚеә”зҡ„иүҜеҘҪеә•зү©гҖӮеңЁеҚ•зӢ¬зҡ„жӯҘйӘӨдёӯж·»еҠ йҖӮеҪ“зҡ„дәІж ёиҜ•еүӮпјҢдҫӢеҰӮ CH 3 O вҖ“ пјҢS N 2 еҸҚеә”еҫҲе®№жҳ“еҸ‘з”ҹпјҢеҫ—еҲ°йҶҡдҪңдёәжңҖз»Ҳдә§зү©дә§е“ҒпјҢеҰӮдёӢеӣҫгҖӮ
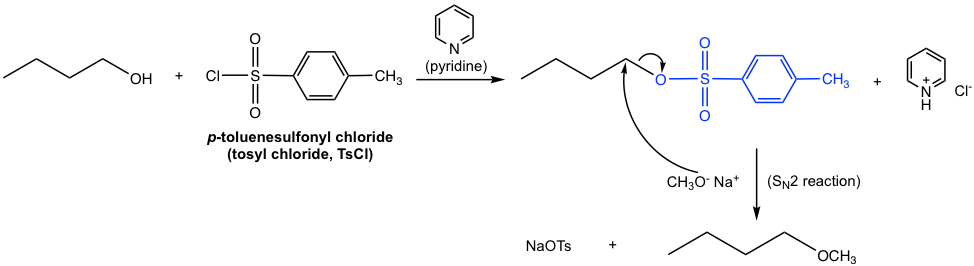
еӣҫ7.6i 1-дёҒйҶҮеҗҲжҲҗдёҒеҹәз”ІеҹәйҶҡзҡ„йҖҗжӯҘжөҒзЁӢпјҲжҳҫзӨәдёӯй—ҙдҪ“з»“жһ„пјү
з”ұ 1-дёҒйҶҮеҗҲжҲҗдёҒеҹәз”ІеҹәйҶҡзҡ„ж•ҙдёӘиҝҮзЁӢеҢ…жӢ¬дёӨдёӘзӢ¬з«Ӣзҡ„жӯҘйӘӨпјҡе°Ҷ OH иҪ¬еҢ–дёә OTsпјҢ然еҗҺйҖҡиҝҮ S N 2 еҸҚеә”з”Ё CH 3 O еҸ–д»Ј OTs гҖӮиҝҷдёӨжӯҘеҝ…йЎ»дҫқж¬ЎиҝӣиЎҢпјӣ然иҖҢпјҢж•ҙдёӘеҗҲжҲҗж–№жЎҲд№ҹеҸҜд»ҘеҰӮдёӢжүҖзӨәпјҡ
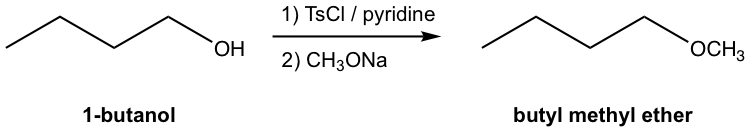
еӣҫ7.6j 1-дёҒйҶҮеҗҲжҲҗдёҒеҹәз”ІеҹәйҶҡжөҒзЁӢеӣҫпјҲжңӘжҳҫзӨәдёӯй—ҙдҪ“з»“жһ„пјү
笔记пјҡ
еӣҫ 7.6j д»ЈиЎЁдәҶжңүжңәеҢ–еӯҰдёӯеӨҡжӯҘеҗҲжҲҗзҡ„еёёи§Ғе’Ңдј з»ҹж–№жі•гҖӮжҜҸдёӘжӯҘйӘӨзҡ„еҸҚеә”жқЎд»¶пјҲиҜ•еүӮгҖҒеӮ¬еҢ–еүӮгҖҒжә¶еүӮгҖҒжё©еәҰзӯүпјүжҳҫзӨәеңЁж–№зЁӢз®ӯеӨҙзҡ„йЎ¶йғЁе’Ңеә•йғЁгҖӮд»…жҳҫзӨәдәҶиө·е§ӢеҺҹж–ҷе’ҢжңҖз»Ҳдә§зү©зҡ„з»“жһ„пјҢдёҚеҢ…жӢ¬жҜҸдёӘжӯҘйӘӨзҡ„дёӯй—ҙдә§зү©зҡ„з»“жһ„гҖӮ
дёәдәҶжӯЈзЎ®зҡ„йЎәеәҸпјҢеҗ„дёӘжӯҘйӘӨйңҖиҰҒж Үи®°дёә 1)гҖҒ2) зӯүпјҢ并且е®ғ们дёҚиғҪж··еҗҲеңЁдёҖиө·гҖӮ
жқҘжәҗдәҺиө„жәҗзҹ©йҳөзҹҘиҜҶжҳҹзҗғгҖҗд»ӘеҷЁеҲҶжһҗеӯҰиӢ‘гҖ‘
жӣҙеӨҡеҶ…е®№зңӢдёӢиҫ№пјҡ
еҪ“дҪ еңЁд»ӘеҷЁеҲҶжһҗе·ҘдҪңзҡ„ж—¶еҖҷпјҡ
жҳҜеҗҰжӣҫдёәдёҖд»ҪжҠҖжңҜж•ҷзЁӢж— еӨ„жүҫеҲ°иҖҢеҸ‘ж„Ғпјҹ жҳҜеҗҰеңЁйҒҮеҲ°й—®йўҳж—¶еҖҷж— дәәи§Јзӯ”пјҹ жҳҜеҗҰйңҖиҰҒжҸҗеҚҮи®ӨзҹҘзҡ„ж—¶еҖҷgoogleдёҚеҲ°иҮӘе·ұжғіиҰҒзҡ„зӯ”жЎҲпјҹ жҳҜеҗҰйқўеҜ№ж—ҘзӣҠжҝҖзғҲзҡ„еҲҶжһҗиЎҢдёҡж— дәәеҲҶжһҗпјҹ жҳҜеҗҰжғіе‘ҠеҲ«йӮЈдәӣжҲҗеӨ©йғҪжҳҜе№ҝе‘Ҡж»ЎеӨ©йЈһзҡ„иЎҢдёҡзӨҫзҫӨпјҹ иҝҷдәӣй—®йўҳеңЁжҲ‘们зҡ„зҹҘиҜҶжҳҹзҗғйғҪиғҪи§ЈеҶіпјҢиҝҷжҳҜд»ӘеҷЁеҲҶжһҗиЎҢдёҡ(иүІи°ұиҙЁи°ұ)дё“еұһзҡ„зҹҘиҜҶжҳҹзҗғпјҢдёҖдёӘеұһдәҺв–¶д»ӘеҷЁеҲҶжһҗв—ҖиүІи°ұиҙЁи°ұиЎҢдёҡзҡ„дјҳиҙЁд»ҳиҙ№зӨҫзҫӨпјҒ е•Ҷдёҡзҡ„еә•еұӮйҖ»иҫ‘жҳҜд»Җд№ҲпјҢжҳҜжңҖзҹӯж—¶й—ҙеҫ—еҲ°жңҖеҮҶзЎ®зҡ„дҝЎжҒҜпјҢеҠ е…ҘзҹҘиҜҶжҳҹзҗғиғҪеё®дҪ иҠӮзәҰе®қиҙөж—¶й—ҙпјҢи®©дҪ дё“жіЁеӯҰд№ пјҢеҲҶдә«пјҢдәӨжөҒпјҒи®©дҪ дё“жіЁдәҺеӯҰд№ гҖҒеҲҶдә«гҖҒдәӨжөҒе’Ңе•ҶдёҡжҙҪи°ҲгҖӮйҖҡиҝҮжңҖдҪҺзҡ„жҲҗжң¬пјҢдҪ еҸҜд»ҘиҺ·еҫ—жңҖеӨ§зҡ„д»·еҖјгҖӮ
з»ҸиҝҮиҝ‘200дёӘж—Ҙж—ҘеӨңеӨңзҡ„з§ҜзҙҜпјҢд»ӘеҷЁеҲҶжһҗеӯҰиӢ‘зҹҘиҜҶжҳҹзҗғе·Із»ҸеӣҠжӢ¬дәҶи¶…иҝҮ100+д»Ҫдә§е“ҒжҠҖжңҜж–ҮжЎЈпјҢи§Ҷйў‘пјҢз»ҸйӘҢеҲҶдә«пјҢиЎҢдёҡжҠҘе‘ҠзӯүзӯүгҖӮ
иҝҳиғҪеҠ е…Ҙзү№е®ҡдәӨжөҒзҫӨеҫ—еҲ°жң¬дәәе’Ңеҗ„дҪҚеӨ§дҪ¬зҡ„жҢҮеҜј
еҸҠе…¶дё°еҜҢзҡ„д№ҰзұҚиө„жәҗпјҢд№ҹеҸҜд»ҘжҸҗдҫӣзӣёе…ізҡ„жҠҖжңҜе’ЁиҜў

йҡҸзқҖиө„ж–ҷйҖҗжёҗеўһеҠ пјҢдјҡе‘ҳдәәж•°йҖҗжёҗеўһеӨҡпјҢжҜҸйҡ”еҚҠе№ҙпјҢжҳҹзҗғд»·ж јдјҡдҫқжҚ®жғ…еҶөзӣёеә”дёҠжө®пјҢж—©еҠ е…ҘпјҢж—©дә«еҸ—пјҢзӯүеҫ…е°ұжҳҜжҲҗжң¬пјҒ
жҳҹзҗғд»·ж јпјҢдёҚиҝҮдёҖйЎҝйҘӯпјҢдҪҶжҳҜжҳҹзҗғеҚҙеҸҜд»ҘжҢҒз»ӯзҡ„з»ҷдҪ жҸҗдҫӣд»·еҖјпјҢеҠ©еҠӣеёӮеңәејҖжӢ“пјҢй”Җе”®еўһй•ҝпјҢиҒҢеңәжҸҗеҚҮгҖӮиҝҳиғҪжү©еӨ§иЎҢдёҡй“ҫжҺҘпјҢеўһеҠ еҲӣеҜҢеҸҜиғҪпјҒ
зӣ®еүҚжү«з Ғе°ұеҸҜд»ҘеҠ е…Ҙпјҡ
зҹҘиҜҶжҳҹзҗғ1пјҡд»ӘеҷЁеҲҶжһҗеӯҰ家зҡ„еҹ№е…»еҹәең°пјҡд»ӘеҷЁеҲҶжһҗеӯҰиӢ‘

зҹҘиҜҶжҳҹзҗғ2пјҡеҸӘйңҖиҰҒжҹҗжҹҗе…ғпјҢдёҖйЎҝиҢ¶ж°ҙй’ұпјҢжү«з ҒжңүжғҠе–ңпјҢеҢ»иҚҜжҠ•иө„гҖҒдәҶи§ЈеҢ»иҚҜеҲӣдёҡпјҢжҠ•иө„пјҢиҒҢдёҡзҡ„е№іеҸ°пјҢйҷ„еёҰзҫӨиө„жәҗ

vxпјҡеҠ жҲ‘еҫ®дҝЎе’ЁиҜўпјҡе…іжіЁе…¬дј—еҸ·-жҲ‘зҡ„-иҒ”зі»жҲ‘们пјҢжү«з ҒеҠ
еҢ»иҚҜд»ӘеҷЁеҲӣдёҡж–№йқўзҡ„зҫӨиҒҠпјҡйӮҖиҜ·еҲ¶жҲ–иҖ…еҠ е…ҘзҹҘиҜҶжҳҹзҗғ В В В В В В В В В жҖ»з»“дёҚжҳ“пјҢеӨ§дҪ¬иӮҜиөһиөҸеҗҰпјҹ END
еЈ°жҳҺпјҡжң¬е…¬дј—еҸ·жүҖжңүиҪ¬иҪҪж–Үз« зі»еҮәдәҺдј йҖ’жӣҙеӨҡдҝЎжҒҜд№Ӣзӣ®зҡ„пјҢдё”жҳҺзЎ®жіЁжҳҺжқҘжәҗе’ҢдҪңиҖ…пјҢдёҚеёҢжңӣиў«иҪ¬иҪҪзҡ„еӘ’дҪ“жҲ–дёӘдәәеҸҜдёҺжҲ‘们иҒ”зі»пјҢжҲ‘们е°Ҷз«ӢеҚіиҝӣиЎҢеҲ йҷӨеӨ„зҗҶгҖӮжүҖжңүж–Үз« д»…д»ЈиЎЁдҪңиҖ…и§ӮзӮ№пјҢдёҚд»ЈиЎЁжң¬з«ҷз«ӢеңәгҖӮ
ж–№жі•ејҖеҸ‘В В В иҪҜ件ж•ҷзЁӢ
еһӮзӣҙж–Үз«
д»ӘеҷЁеҲҶжһҗеӨ§зҷҫ科全д№Ұ-жңүжңәеҢ–еӯҰ-5.4 еҜ№жҳ дҪ“е…үеӯҰжҙ»жҖ§
д»ӘеҷЁеҲҶжһҗеӨ§зҷҫ科全д№Ұ-жңүжңәеҢ–еӯҰ-жүӢжҖ§е’Ң R/S е‘ҪеҗҚзі»з»ҹ
д»ӘеҷЁеҲҶжһҗеӨ§зҷҫ科全д№Ұ-жңүжңәеҢ–еӯҰ-зғҜзғғзҡ„еҮ дҪ•ејӮжһ„дҪ“
д»ӘеҷЁеҲҶжһҗеӨ§зҷҫ科全д№Ұ-жңүжңәеҢ–еӯҰ-4.1 зғ·зғғзҡ„жһ„иұЎеҲҶжһҗ
д»ӘеҷЁеҲҶжһҗеӨ§зҷҫ科全д№Ұ-жңүжңәеҢ–еӯҰ-3.5 и·Ҝжҳ“ж–Ҝй…ёе’Ңи·Ҝжҳ“ж–Ҝзўұ
д»ӘеҷЁеҲҶжһҗеӨ§зҷҫ科全д№Ұ-жңүжңәеҢ–еӯҰ-е…ғзҙ еҪұе“Қ
д»ӘеҷЁеҲҶжһҗеӨ§зҷҫ科全д№Ұ-жңүжңәеҢ–еӯҰ-жңүжңәй…ёгҖҒжңүжңәзўұеҸҠжңүжңәеҸҚеә”жңәзҗҶ
д»ӘеҷЁеҲҶжһҗеӨ§зҷҫ科全д№Ұ-жңүжңәеҢ–еӯҰ-й…ёзўұе’ҢKaзҡ„еӣһйЎҫ
д»ӘеҷЁеҲҶжһҗеӨ§зҷҫ科全д№Ұ-жңүжңәеҢ–еӯҰ-е®ҳиғҪеӣўзҡ„жңүжңәеҢ–еҗҲзү©зҡ„е‘ҪеҗҚ
д»ӘеҷЁеҲҶжһҗеӨ§зҷҫ科全д№Ұ-жңүжңәеҢ–еӯҰ-2.2 зғ·зғғзҡ„е‘ҪеҗҚ
д»ӘеҷЁеҲҶжһҗеӨ§зҷҫ科全д№Ұ-жңүжңәеҢ–еӯҰ-2.3 е®ҳиғҪеӣў
д»ӘеҷЁеҲҶжһҗеӨ§зҷҫ科全д№Ұ-жңүжңәеҢ–еӯҰ-2.1 зғҜзғғзҡ„з»“жһ„
д»ӘеҷЁеҲҶжһҗеӨ§зҷҫ科全д№Ұ-жңүжңәеҢ–еӯҰ-1.6 д»·й”®зҗҶи®әдёҺжқӮеҢ–
д»ӘеҷЁеҲҶжһҗеӨ§зҷҫ科全д№Ұ-жңүжңәеҢ–еӯҰ-1.5 д»·еЈіз”өеӯҗеҜ№жҺ’ж–ҘзҗҶи®әпјҲVSEPRпјү