【一图读懂】医疗器械法规+注册+体系系列汇编(200+份)
国家药监局--医疗器械监督管理条例培训(课件141页)
医疗器械监督管理条例培训教程(PPT-77页)
医疗器械监督管理条例--第739号培训(PPT-100页)
内部审核相关知识学习(PPT-77页)
洁净室知识培训(PPT-55页)
医疗器械临床试验法规介绍(PPT-198页)
经营质量管理规范及现场检查指导原则(含罚则)(PPT-127页)
体外诊断试剂临床试验技术指导原则(PPT-96页)
环氧乙烷(EO)灭菌知识交流学习(PPT-78页)
医疗器械生产质量管理规范现场检查指导原则学习(PPT-61页)
无菌及环氧乙烷残留量检测学习(PPT-42页)
医疗器械生产过程清洗确认学习(PPT-37页)
洁净厂房清洁消毒培训(PPT-49页)
医疗器械辐照灭菌学习(PPT-29页)
净化空调系统基础知识(PPT-42页)
特殊过程确认学习(PPT-41页)
微生物基础知识培训(PPT-70页)
医械设计开发培训(PPT-55页)
医疗器械生产许可时的现场核查(PPT-62页)
医疗器械经营质量管理规范培训(PPT-35页)
生产卫生管理培训(PPT-35页)
仓库管理知识培训(PPT-43页)
医疗器械产品设计开发与质量管理体系、咨询问答专栏介绍(PPT-86页)
内审以及管理评审基础知识和流程培训(PPT-52页)
纯化水系统知识培训(PPT-43页)
生产现场标识管理学习(PPT-66页)
洁净室的管理及其要求 -132页
生产计划及管理培训(PPT-39页)
医疗器械生产质量管理规范培训(PPT-70页)
CAPA法规解读和经验分享(课件59页)
医疗器械生产质量管理规范及飞检案例(课件72页)
MDR与ISO13485的关系(课件55页)
洁净厂房辅助设施的选型和使用(课件67页)
生产运营管理(课件200页)
医疗器械生产质量管理规范-体外诊断试剂(课件48页)
细菌内毒素检查法培训(课件33页)
188页ISO9001-2015内审员培训课件
医疗器械设计开发培训--55页
MDR中涉及QMS质量体系改版培训
洁净区微生物知识培训(课件70页)
内审以及管理评审基础知识和流程培训(PPT-52页)
欧盟IVDR培训教程(PPT--62页)
质量意识培训
【培训课件】医疗器械不合格品控制
46. 【培训课件】8D根本原因分析之5WHY与鱼骨图完整版(63页)
47.【培训课件】医疗器械设计开发培训--55页
48.【培训课件】医疗器械生产质量管理规范及现场检查常见问题分析培训课件--72页
49.【培训课件】MDR中涉及QMS质量体系改版培训
50.【培训课件】IVDR法规培训(62页)
51.【培训课件】医疗器械不合格品控制
52.【培训课件】洁净区微生物知识培训(课件70页)
53.【培训课件】环氧乙烷灭菌知识交流(78页)
54.【培训课件】内审以及管理评审基础知识和流程培训(PPT-52页)
55.【培训课件】注册申报资料要求及提示(45页)
56.【培训课件】医疗器械生产经营监督管理办法解读-PPT
57.【培训课件】欧盟MDR与ISO13485的关系(课件54页)
58.【培训课件】环氧乙烷灭菌(ISO11135)--103页
59.【培训课件】洁净区知识培训(55页)
60.【培训课件】医疗器械无菌和初始污染菌检验(50页)
61.【培训课件】医疗器械行业适用法规
62.【培训课件】医疗器械行业适用法规
63.【培训课件】医疗器械注册人备案人自检条件和要求相关文件学习分享(109页)
64.【培训课件】医疗器械风险管理培训课件
65.【培训课件】医疗器械生产企业管理者代表管理指南
66.【培训课件】细菌内毒素检查法培训PPT
67.【培训课件】医疗器械生产质量管理规范及现场检查常见问题分析培训课件--72页
68.【培训课件】医疗器械生产质量管理规范及附录体外诊断试剂讲义
69.【培训课件】质量管理七大原则(课件53页)
70.【培训课件】EO灭菌确认(培训课件185页)
71.【培训课件】医疗器械生产质量管理规范----机构与人员、文件管理(课件45页)
72.【培训课件】GMP-纠正措施和预防措施(CAPA)
73.【培训课件】8D根本原因分析之5WHY与鱼骨图完整版(63页)
74.【培训课件】医疗器械设计开发培训--55页
75.【培训课件】医疗器械生产质量管理规范及现场检查常见问题分析培训课件--72页
76.【培训课件】MDR中涉及QMS质量体系改版培训
77.【培训课件】IVDR法规培训(62页)
78.【培训课件】医疗器械不合格品控制
79.【培训课件】洁净区微生物知识培训(课件70页)
80.【培训课件】环氧乙烷灭菌知识交流(78页)
81.【培训课件】内审以及管理评审基础知识和流程培训(PPT-52页)
82.【培训课件】注册申报资料要求及提示(45页)
83.【培训课件】医疗器械生产经营监督管理办法解读-PPT
84.【UDI专辑】详细操作讲解医疗器械UDI
85.【培训课件】欧盟MDR与ISO13485的关系(课件54页)
86.【培训课件】环氧乙烷灭菌(ISO11135)--103页
87.【培训课件】洁净区知识培训(55页)
88.【培训课件】医疗器械无菌和初始污染菌检验(50页)
89.【培训课件】医疗器械行业适用法规
90.【培训课件】医疗器械行业适用法规
91.【培训课件】医疗器械注册人备案人自检条件和要求相关文件学习分享(109页)
92.【培训课件】医疗器械风险管理培训课件
93.【培训课件】医疗器械生产企业管理者代表管理指南
94.【培训课件】细菌内毒素检查法培训PPT
95.【培训课件】医疗器械生产质量管理规范及现场检查常见问题分析培训课件--72页
96.【培训课件】医疗器械生产质量管理规范及附录体外诊断试剂讲义
97.【培训课件】质量管理七大原则(课件53页)
98.【培训课件】EO灭菌确认(培训课件185页)
99.【培训课件】医疗器械生产质量管理规范----机构与人员、文件管理(课件45页)
100【培训课件】GMP-纠正措施和预防措施(CAPA)
101【培训课件】医疗器械生产质量管理规范----厂房与设施、设备(课件62页)
102【培训课件】医疗器械注册申报资料要求及说明—质量管理体系文件(课件48页)
103【培训课件】医疗器械空气处理系统(课件107页)
104【培训课件】医疗器械批生产记录相关知识培训
105【培训课件】GB/T 42062-2022 & ISO 14971-2019 风险管理培训课件(69页)
106【培训课件】医疗器械软件和网络安全要求培训课件(40页)
107【培训课件】欧盟MDR培训课件(131页)
108【PPT】医疗器械飞行检查介绍
109【培训课件】IVDR详细解读(课件62页)
110【培训课件】医疗器械检(化)验员培训-微生物实验指导(119页)
111『医疗器械生产企业质量控制与成品放行』PPT
112【培训课件】中国药典的微生物检测
113【培训课件】医疗器械洁净室空调系统详细解读-课件107页
114.【培训课件】医疗器械不良事件监测学习课件(76页)
115.【培训课件】医疗器械经营质量管理规范及现场检查指导原则培训教程126页
116.【培训课件】医疗器械注册质量管理体系核查指南介绍-88页
国际法规培训(示例),已共享300+份培训课件::
ISO13485-2016内审员培训教程(PPT--213页)
欧盟IVDR培训教程(PPT--62页)
欧盟IVDR--PMS、PMPF、Vs、FSCA、Trend Report(PPT-14页)
欧盟MDR培训教程(PPT--131页)
MDR中涉及QMS质量体系改版培训(PPT-25页)
巴西医疗器械GMP培训教程(PPT-77页)
美国医疗器械法规(QSR820)培训(PPT-98页)
QSR820 & FDA工厂检查--医疗器械(PPT-70页)
21 CFR Part11培训教程(PPT--54页)
参考模板(示例),已共享体系模板200+份:
参考模板--医疗器械上市后临床跟踪控制程序
参考模板--ISO14971:2019医疗器械风险管理控制程序
参考模板(10页)--医疗器械唯一标识(UDI)控制程序
参考模板--巴西体外诊断医疗器械注册工作指南
参考模板(7页)--产品上市后监督报告(PMS报告)
参考模板--飞行检查准备程序(国内飞检、MDR&IVDR飞检)
【参考模板】新版医疗器械安全和性能基本原则清单(已填内容)
参考模板--欧盟MDR通用安全和性能要求检查表GSPR Check List
【参考模板】研发+注册+体系模板(150+份)
【参考模板】精品ISO9001-2015质量管理体系全套文件(手册+程序文件及风险评估风险机遇控制表共200页)
【参考模板】医疗器械加速老化实验技术方案及报告
参考模板--医疗器械风险管理计划和风险管理报告
【资料下载】ISO13485-2016体系模板一套(100+份)
【资料下载】最新版医疗器械法规汇编(可编辑版)(1734页)
【资料下载】第二类医疗器械和体外诊断试剂注册提交资料模板
【资料下载】医疗器械验证资料汇编(模板90+份)
【资料下载】欧盟MDR认证提交资料模板(一整套)
超级VIP业务介绍:
包含所有会员权益(一个超级企业会员Q群资料+一个普通会员Q群资料+一个超级企业会员微信群+一个企业会员知识星球);
资料库9000+份,加入会员即可入群打包快捷下载,持续新增,共享资料包括培训教程(包含监管机构培训课件+原创培训课件)+国内/国际/ISO/GB/YY法规标准+注册/体系/研发/验证/管理模板等
VIP-Pro超级企业会员原价3650元/年
限时优惠价
668元/年(老会员第二年享6折优惠399元加入)
已加入普通会员和知识星球会员如需升级企业会员,享受9折优惠599元减去加入时已支付费用即可升级
(有效期:自加入之日起有效期1年)
资料库(1个企业超级会员QQ群资料+一个普通会员QQ群资料权益+一个企业VIP知识星球):
企业超级会员Q群+个人会员Q群


↓↓扫码加入会员↓↓

加入会员,可下载星球内的9000+份资料
网址 :https://wx.zsxq.com/dweb2/index/group/88855211122522

知识星球内容(会员包括)

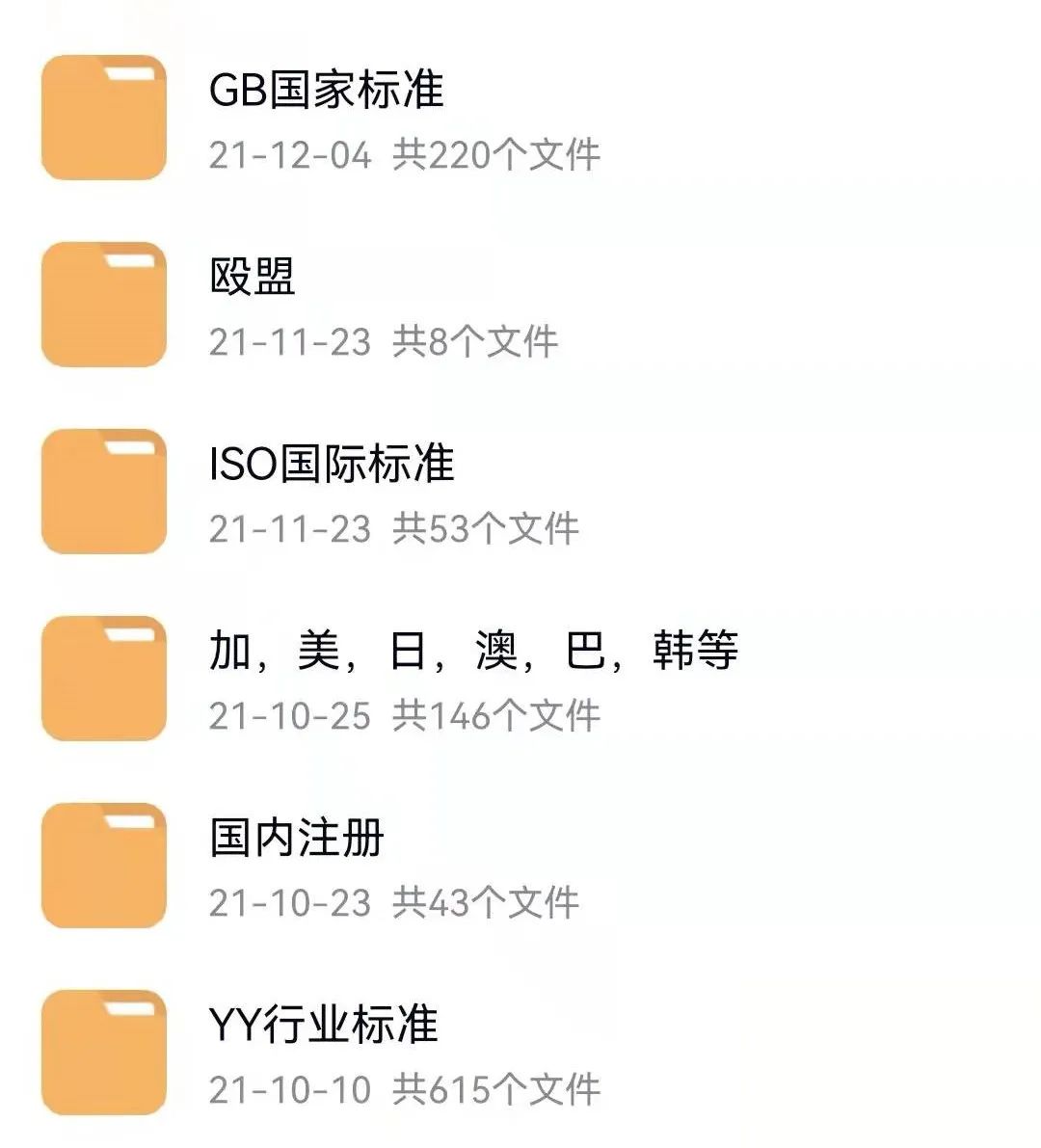
一图读懂医疗器械法规/注册/体系系列汇编(300+份)
原创一图读懂系列(300+份持续新增):



第二类医疗器械注册提交参考模板
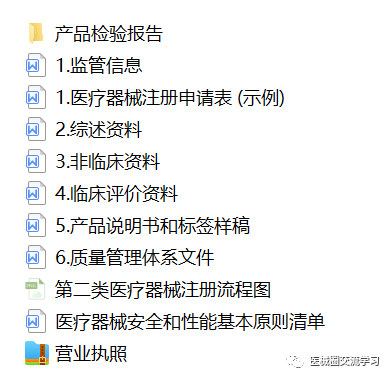


第二类体外诊断试剂注册提交参考模板



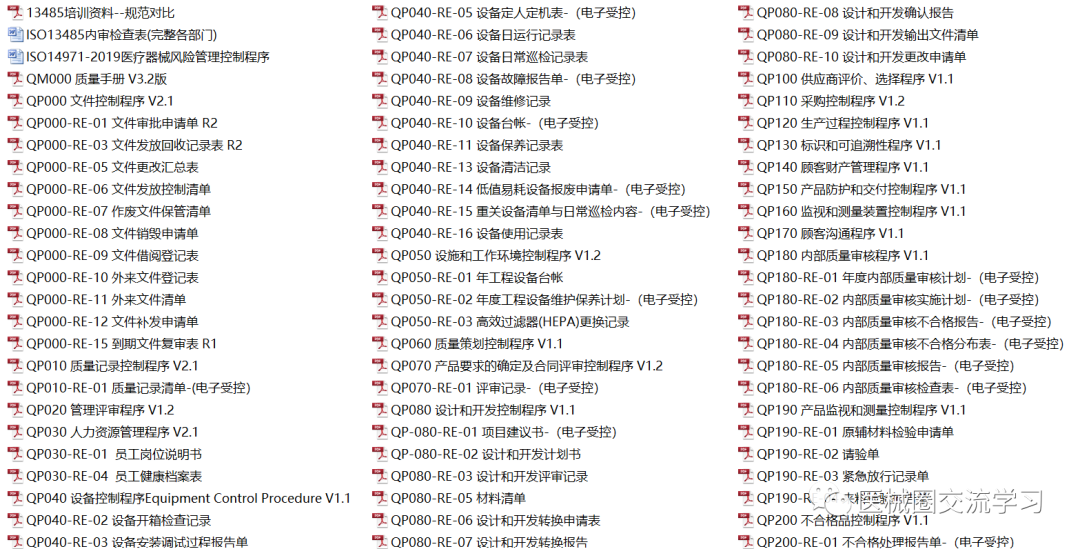
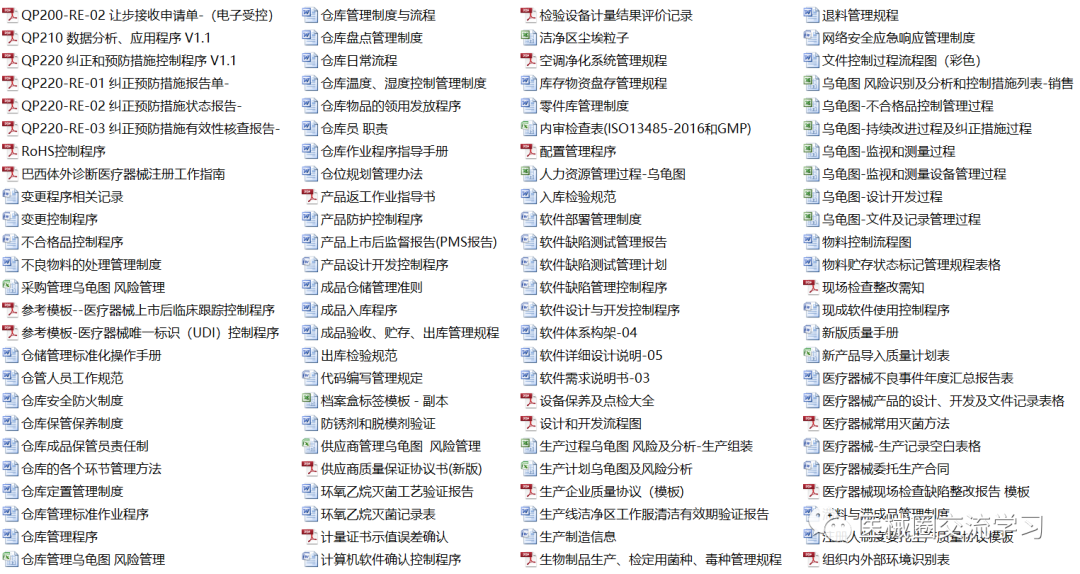
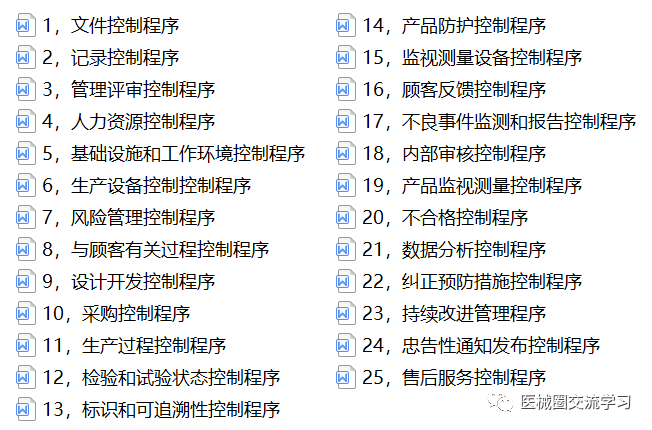
质量体系文件2套(300+份)



经营体系一套(共32份):


培训资料(价值上万元),加入会员免费打包下载(持续新增)
内部培训资料+监管机构培训资料(目前300+份):





UDI专栏培训资料:

欧盟MDR认证提交技术文档模板
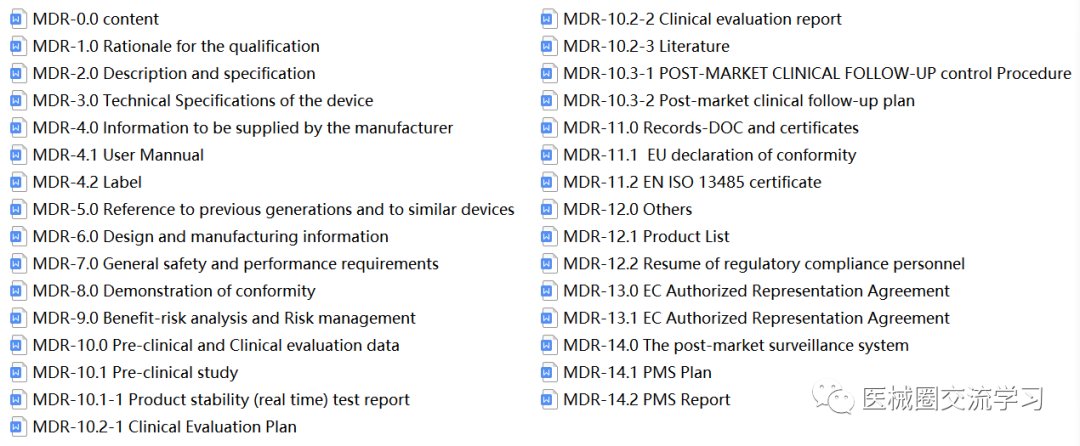
注册要求及模板等:



验证模板:


软件模板:

注册技术审查指导原则:
















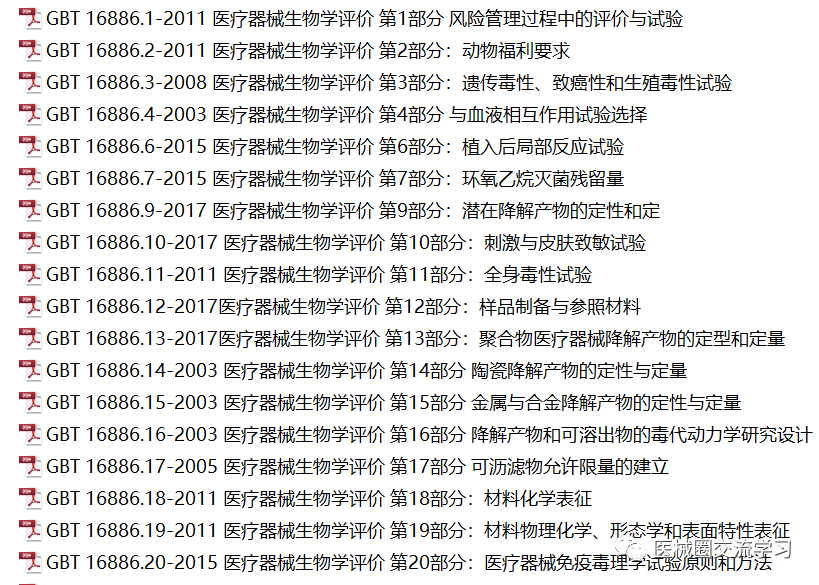
欧盟MDR、IVDR、MDCG指南,协调标准等:

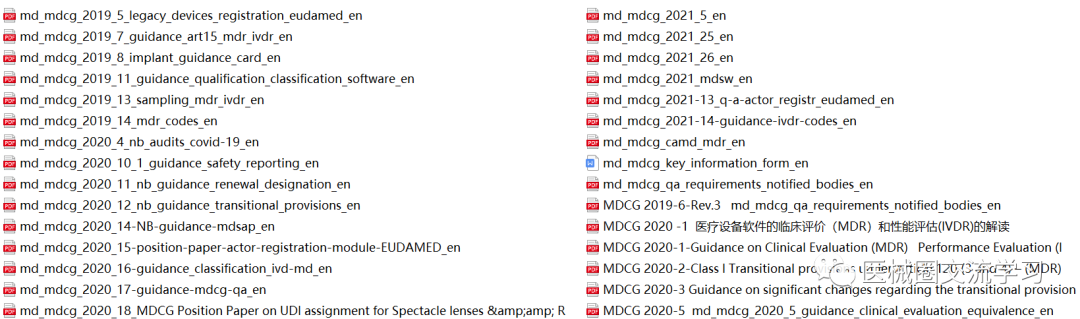
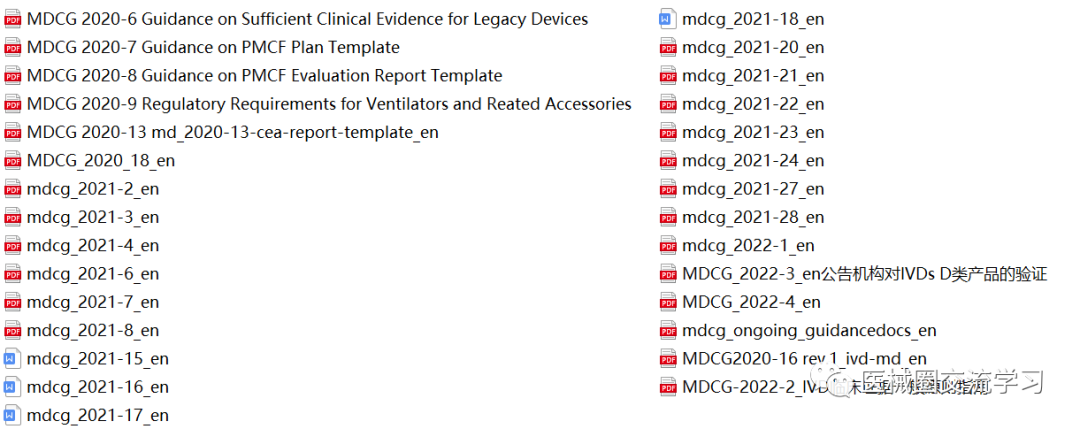
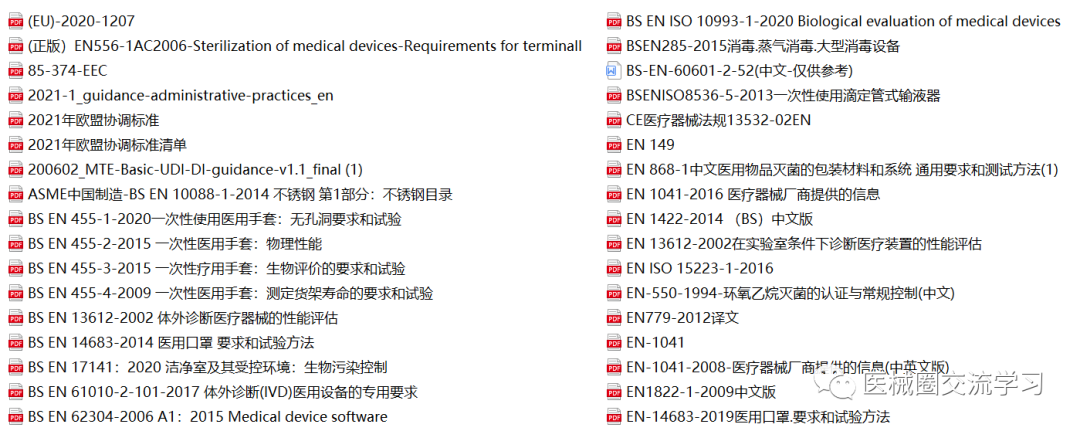

CE标准(MDR+IVDR)


知识星球内容(会员包括)
FDA要求:



FDA通用指南(中文版,共326+份)
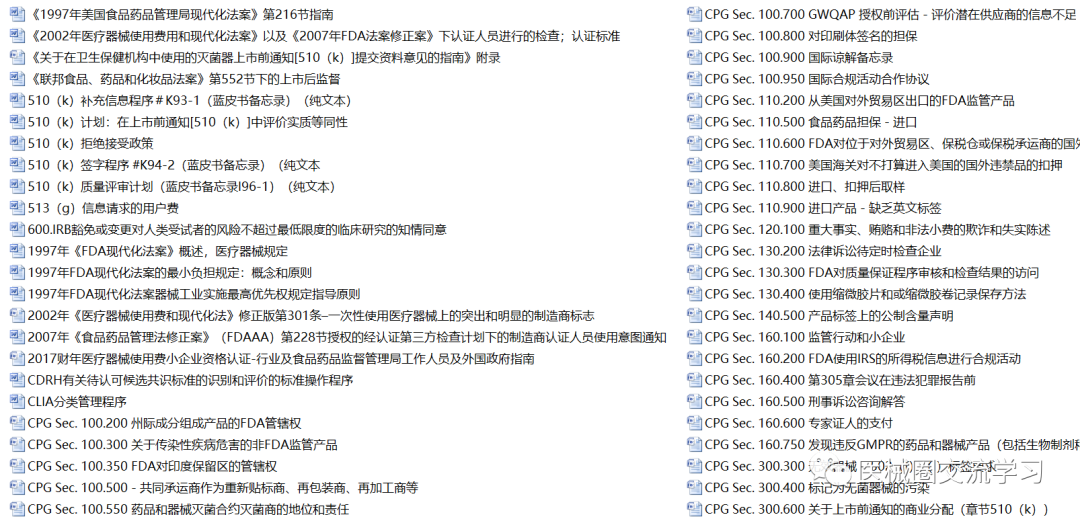

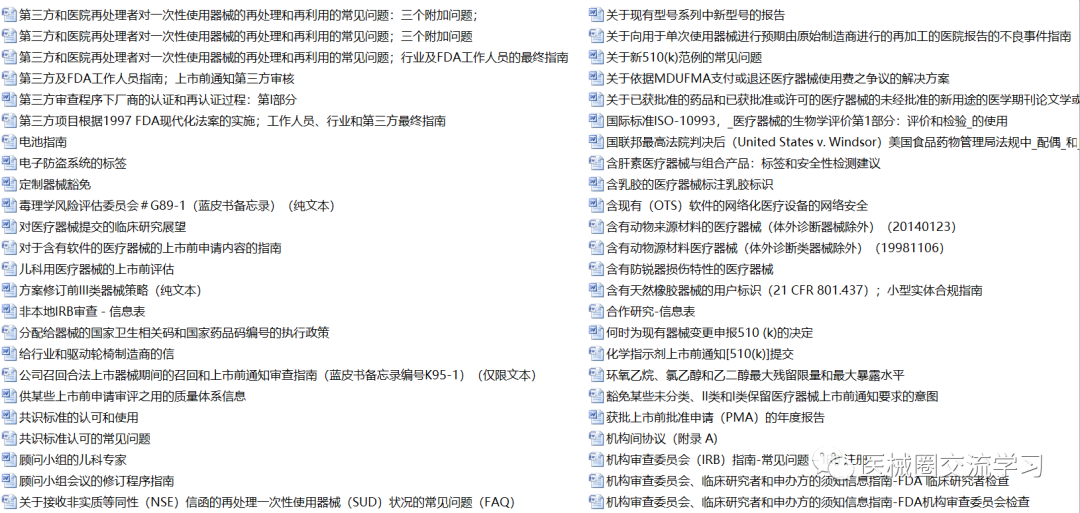

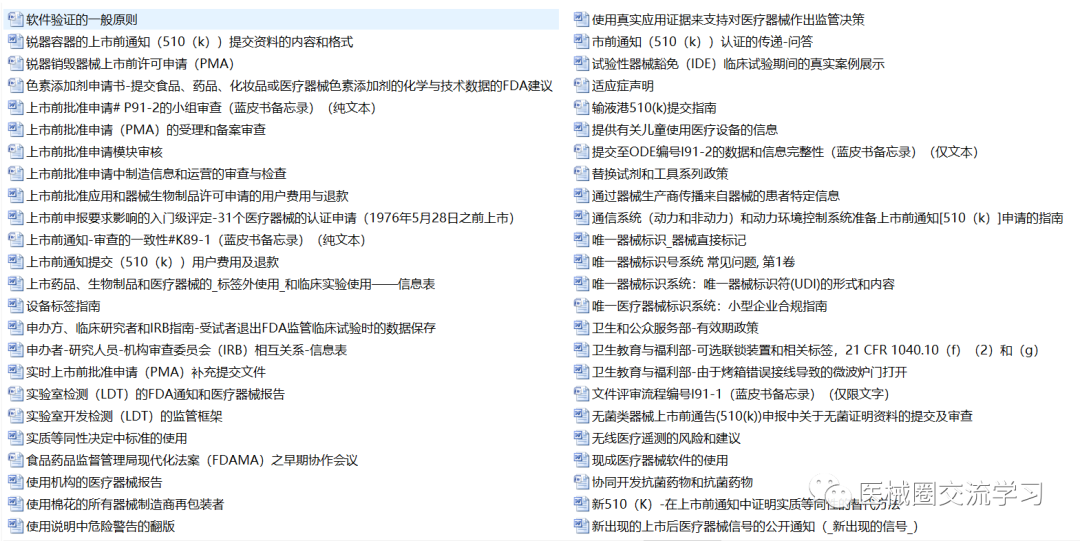
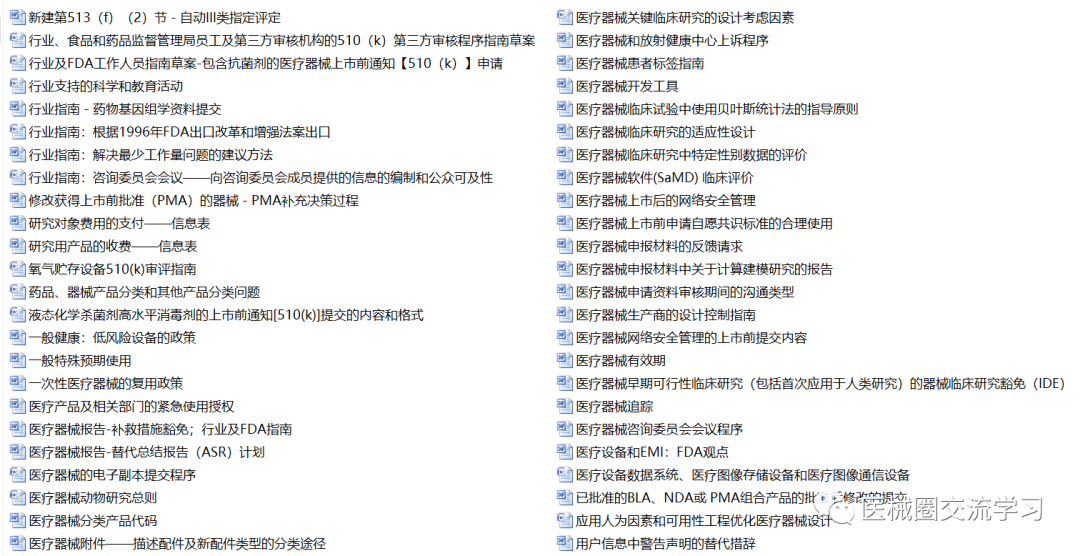

FDA产品指南(400+份)
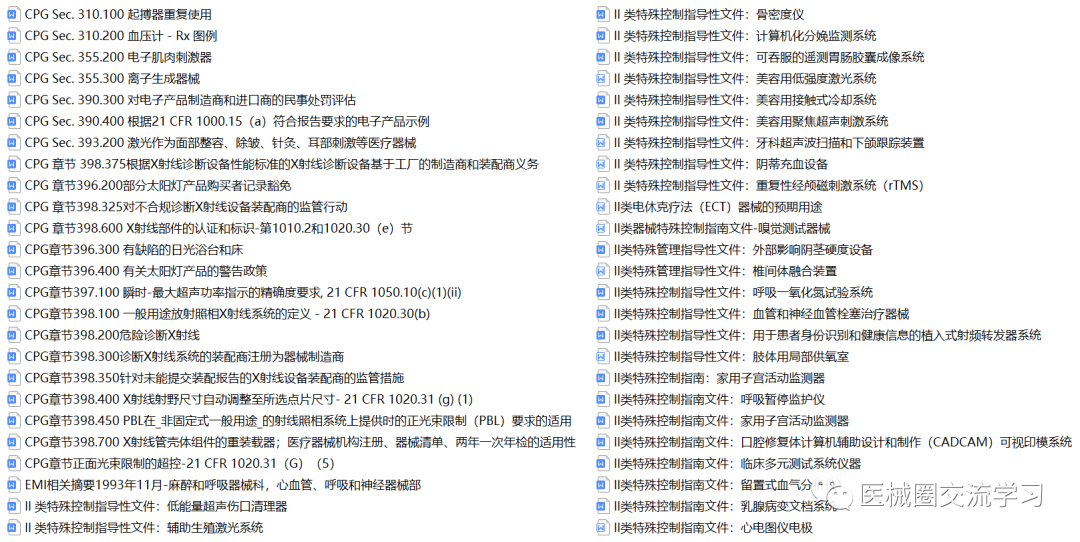




510K指南,研发模板等:



随着篇数增多不断上调,越早加入越划算,新会员越迟加入越贵,老会员很实惠!
资料价值上万元(涵盖医疗器械相关ISO13485,MDSAP,欧盟MDR,欧盟IVDR,英国,GMP,GSP,GCP,GLP,NMPA注册,510K,QSR820,FDA,巴西,加拿大,澳大利亚,日本,韩国等其他国际法规)
走过路过,千万不要错过!大咖们都在不断努力充电,加入会员与大咖共成长。
加入会员的好处:
1. 免费获得本平台已发布的一图读懂系列高清版资料包+QQ-VIP-Pro群共享文件(9000+份资料);绝对行业内精品;
2. 加入会员后1年可免费共享下载本平台持续每期分享的一图读懂系列高清版资料+QQ-VIP-Pro群共享文件;
3. 会员将进入“广汇医疗圈VIP-Pro”微信群+QQ-VIP-Pro群;免费加入“广汇医疗圈”微信交流群;
4. 本平台每期发布的一图读懂系列高清版+QQ-VIP-Pro群共享文件会在会员群免费共享1年;
5. 学习提升自我价值,获得更高身价,掌握精华后年薪50万以上不是梦;
花一顿饭钱 +努力学习挑战50万以上年薪;
6. 让医疗器械相关企业合法合规,轻松让您应对和通过各种监管与审核;
7. 认识更多业界精英(含有源,无源,无菌,植入,IVD,医疗软件,认证机构,咨询公司,检测机构,洁净厂房装修,欧盟代表等各路专业人员), 获得更多的资源(有资源就有办法);
8. 为人类生命健康事业而奋斗,为“中国智造”“中国制造”“中国质造”做出贡献!
9. “一图读懂系列”导图式阅读医疗器械法规,避免长篇大论,一目了然,重点标注;
10. 会员坚持学习一年,成为行业内专家;
11. 为您节省上万元培训费+上十万咨询辅导费!
12. 熟能生巧,每个企业文化和组织结构及运营管理不一样, 产品也不一样,避免千遍一律套模板;
13.本平台会员群共享资源均免费;
14.几千份资料,减少搜索费用,让您有各种参照,少走弯路。
加微信加入医疗圈。
俗话说:圈子那么小,到哪都能遇见熟人,在圈子内与熟人共成长!
























































































